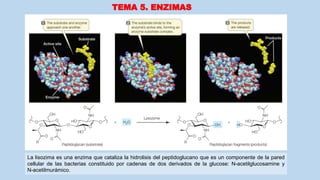
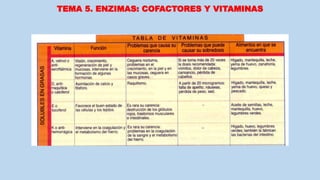
Este documento trata sobre enzimas y su papel en las reacciones bioquímicas. Explica que las enzimas son proteínas que actúan como catalizadores biológicos acelerando las reacciones mediante la disminución de la energía de activación requerida. Algunas enzimas requieren cofactores como iones metálicos o coenzimas para su actividad catalítica. También describe los conceptos de especificidad enzimática, mecanismo de catálisis enzimática y la relación entre vitaminas y coenzimas.


















![FACTORES QUE INTERVIENEN EN LA ACTIVIDAD ENZIMÁTICA
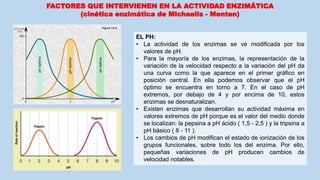
(cinética enzimática de Michaelis - Menten)
La constante Km se expresa en unidades de molaridad, mM (milimoles por litro), y representa la concentración de
sustrato a la que la velocidad de la reacción es la mitad de la velocidad máxima del proceso. Es un valor específico de
cada enzima para un sustrato concreto e indica la afinidad que presenta la enzima por el sustrato, o sea la mayor o
menor especificidad de la reacción: cuanto mayor es la Km, mayor es la [S] necesaria para conseguir la velocidad
semimáxima y, por tanto, la afinidad enzima-sustrato es menor.
A
B
C](https://image.slidesharecdn.com/tema5-201103005650/85/Enzimas-21-320.jpg)