Htf sustancia pura formulario
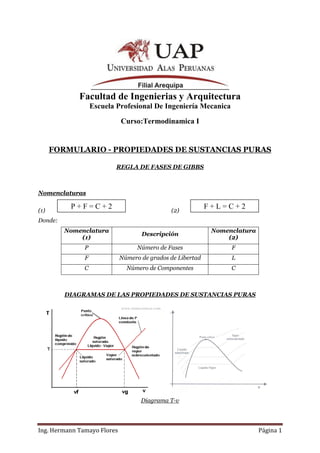
- 1. Facultad de Ingenierias y Arquitectura Escuela Profesional De Ingeniería Mecanica Curso:Termodinamica I FORMULARIO - PROPIEDADES DE SUSTANCIAS PURAS REGLA DE FASES DE GIBBS Nomenclaturas (1) P+F=C+2 (2) F+L=C+2 Donde: Nomenclatura Nomenclatura Descripción (1) (2) P Número de Fases F F Número de grados de Libertad L C Número de Componentes C DIAGRAMAS DE LAS PROPIEDADES DE SUSTANCIAS PURAS Diagrama T-v Ing. Hermann Tamayo Flores Página 1
- 2. Diagrama P-v Diagrama P-T - (Diagrama de Fases) Liquido sub-enfriado o Liquido Comprimido Estado de la sustancia totalmente en fase líquida. a) Líquido sub-enfriado: cuando la sustancia está en fase líquida a T < Tsat - para una presión determinada. b) Líquido comprimido: cuando la sustancia está en fase líquida a P > Psat - para una temperatura determinada. Liquido Saturado Estado de la sustancia en fase líquida a punto de evaporarse. La sustancia está totalmente en fase líquida sin nada de fase vapor. Mezcla Liquido Saturado mas Vapor Saturado (Liquido + Vapor) Estado de la sustancia en equilibrio líquido – gas. Coexiste al mismo tiempo líquido y vapor a una cierta presión y temperatura únicas para ambas fases de la sustancia. Vapor Saturado o Vapor Saturado Seco Estado de la sustancia en fase vapor a punto de condensarse. La sustancia está totalmente en fase vapor sin nada de fase líquida. Vapor sobrecalentado Estado de una sustancia totalmente en fase gaseosa y alejada del punto de saturación de vapor. La sustancia está totalmente en fase gaseosa a una temperatura mayor que la temperatura de saturación (T > Tsat) - para una presión determinada. Calor Latente - (Calor latente de cambio de fase (r)) Calor necesario para efectuar el cambio de fase. Durante el cambio de fase, la temperatura y la presión se mantienen constantes, en infinitos estados de equilibrio (líquido + vapor). Ing. Hermann Tamayo Flores Página 2
- 3. a) Calor latente de fusión:)Cantidad de energía en forma de calor que absorbe la sustancia durante la fusión, equivalente a la energía liberada durante la solidificación (congelación) también en forma de calor. b) Calor latente de evaporación: Cantidad de energía en forma de calor que absorbe la sustancia durante la evaporación, equivalente a la energía liberada durante la condensación (licuefacción) también en forma de calor. Punto Crítico Valores de presión y temperatura máximos de una sustancia para el estado de mezcla (Líquido + Vapor) en equilibrio.. Temperatura de Saturación y Presión de Saturación Temperatura y Presión a la cual una sustancia pura comienza a cambiar de fase. La temperatura de saturación, siempre va a tener ligada una sola presión de saturación.. a) Temperatura de Saturación es la temperatura de ebullición para una presión determinada b) Presión de Saturación es la presión de ebullición para una temperatura determinada. El aporte de calor se realiza en tres etapas 1) Calentamiento del líquido 2) Cambo de fase 3) Calentamiento del vapor Q = Qcl + Qcf + Qcv Por ser un proceso a presión constante se calcula a partir del calor especifico a presión constante (Cp), excepto en la zona de cambio de fase, donde se aplica el calor latente de cambio de fase,(El valor de Cp sería infinito al ser la temperatura constante Q = mCp(líquido)Tlíquido + mr + mCp(vapor)Tvapor Calidad y Humedad La CALIDAD es la cantidad de masa de vapor con respecto a la cantidad de masa total de la sustancia. Si la sustancia está toda en fase vapor, la calidad = 1. Si está toda en fase líquida, la calidad = 0. La HUMEDAD es la cantidad de masa de líquido con respecto a la cantidad de masa total de la sustancia. Si la sustancia está toda en fase líquida, la humedad = 1. Si está toda en fase vapor, la humedad = 0. Ecuaciones para hallar la Calidad y Humedad 1. m = mf + mg Masa _ del _ Vapor mg v v f v vf Calidad X Masa _ Total m v fg vg v f 2. Masa _ del _ Liquido m f vg v vg v 3. Humedad Y Masa _ Total m v fg vg v f v v f Xv fg 4. v vg Yv fg 5. 6. X Y 1 V v 7. m Ing. Hermann Tamayo Flores Página 3
- 4. 8. mf m 9. v v f g vg v 1 X v f Xvg v Yv f Xvg m m v vf v vf 10. X vg v f v fg Donde: X = Calidad de la mezcla Y = Humedad de la mezcla m = Masa total de la sustancia (Liquido + Vapor) mg = Masa de la sustancia en Fase Vapor mf = Masa de la sustancia en Fase Liquida V = Volumen total (Variable extensiva) v = volumen específico promedio. vf = volumen específico del líquido. vg = volumen específico del vapor. vfg = (vg – vf) 11. h u Pv - (Entalpia Especifica En general para cualquier propiedad o variable especifica “n” n nf n nf 12. X ng n f n fg 13. n n f Xn fg 14. n = Xng + (1 – X)nl 15. n ng Yn fg N 16. n m Donde: X = Calidad de la mezcla Y = Humedad de la mezcla m = Masa total de la sustancia (Liquido + Vapor = mf + mg) N = Variable extensiva n = Variable específica Promedio. nf = Variable específica del líquido. ng = Variable específica del vapor. nfg = (ng – nf) Ing. Hermann Tamayo Flores Página 4
- 5. GASES IDEALES Formas de las ecuaciones de Gases Ideales Rp = Ru / M Donde: P: presión absoluta. V: volumen. n: número de moles. Ru: Constante Universal de los gases ideales. T: temperatura aboluta. M: peso molecular. Llamado también Masa molar. Rp: Constante particular del gas. m: masa. v: volumen específico del gas. ρ: densidad. Para clarificar las ecuaciones se debe tener en cuenta lo siguiente. M.n = m. v = V/m. ρ = m/V Propiedades Reducidas: P Pr Pc T Tr Tc Donde: Pr = Presion reducida P = Presion del gas Pc = Presión Crítica del gas Tr = Temperatura Reducida T = Temperatura del gas Tc = Temperatura Crítica del gas Ing. Hermann Tamayo Flores Página 5
- 6. Valores de la Constante Universal (Ru) de los gases: 1 545,33 lb x pie / lb-mol x °R 1,98588 BTU / Lb-mol x °R 1,98588 cal / g-mol x °K 0,082054 l-atm / g-mol x °K 8,314 J / g-mol x °K 0,7302 atm-pie / lb-mol x °R 10,731 psi x pie3 / lb-mol x °R Ecuaciones de Estado: n2 P a 2 V nb nRuT P RuT 2a De Van Der Waals: V V b V RuT a De Redlich – Kwong: P V b V V b T 0.5 RT 1 De Beattie – Bridgeman: P V 2 V B VA2 TABLAS DE PROPIEDADES TABLAS POR FASES Tabla1. Agua Saturada (L+V) - Temperaturas VOLUMEN ESPECÍFICO m3/kg TEMP. PRES. LIQ.SAT VAP.SAT T ºC Psat kPa vf vg 0.01 0.6117 0.001000 206.000 5 0.8725 0.001000 147.030 ... ... ... ... 155 543.49 0.001096 0.34648 ... ... ... ... 370 21.044 0.002217 0.004953 373.95 22.064 0.003106 0.003106 Ing. Hermann Tamayo Flores Página 6
- 7. Tabla 2. Agua Saturada (L + V) - Presiones VOLUMEN ESPECÍFICO m3/kg PRES. TEMP. LIQ.SAT VAP.SAT P kPa Tsat ºC vf vg 0.01 0.6117 0.001000 206.000 5 0.8725 0.001000 147.030 ... ... ... ... 155 543.49 0.001096 0.34648 ... ... ... ... 370 21.044 0.002217 0.004953 373.95 22.064 0.003106 0.003106 Tabla3.Vapor de agua sobrecalentado T v u h s v u h s ºC m3/kg kJ/kg kJ/kg kJ/kg.K m3/kg kJ/kg kJ/kg kJ/kg.K P = 0.5 MPa (151.83ºC) P = 0.6 MPa (158.83ºC) Sat 0.37483 2560.7 2748.1 6.8207 0.31560 2566.8 2756.2 6.7593 200 0.42503 2643.3 2855.8 7.0610 0.35212 2639.4 2850.6 6.9683 250 0.47443 2723.8 2961.0 7.2725 0.39390 2721.2 2957.6 7.1833 ... ... ... ... ... ... ... ... ... 1300 1.45214 4686.6 5412.6 9.7797 1.21012 4686.4 5412.5 9.6955 Como se puede apreciar en los diagramas inferiores, con respecto al vapor saturado, el sobrecalentado tiene P<Psat, T>Tsat, v>vg, energías internas u>ug y entalpías h>hg. Ing. Hermann Tamayo Flores Página 7
- 8. INTERPOLACIONES (Como semejanza de triangulos) Teniendo y Teniendo x Ejemplo de Interpolación como semejanza de triángulos: Calcular el volumen específico del líquido saturado, vf, conociendo la temperatura, T=372ºC, con agua como sustancia. Para el ejemplo utilizaremos la tabla 1 de ( L+V) saturados mostrada arriba. Como 372º C está entre 370 y 373.95 ºC, tomamos estos dos valores de T como si estuvieran sobre el eje X, y sus respectivos valores de vf como si estuvieran sobre el eje Y. El valor de 372º C del cual queremos hallar su correspondiente vf, nos plantea hallar solo una incógnita en la ecuación de arriba. Los valores han sido tomados de la Tabla 1 (L+V) lineas arriba. Todo esto se aprecia mas claramente en la tabla siguiente. X Y Punto 1 370 0.002217 Por hallar x y Punto 2 373.95 0.003106 Así, aplicando la ecuacion para y, (es decir, para el vf), tenemos: y = vf = 0.002667 m3/kg. Valor que, según lo esperado, está entre 0.002217 y 0.003106 m3/kg. Ing. Hermann Tamayo Flores Página 8
- 9. PROYECCIONES DE LAS SUPERFICIES TERMODINAMICAS Ing. Hermann Tamayo Flores Página 9
- 10. O==========-o-==========O Ing. Hermann Tamayo Flores Página 10
