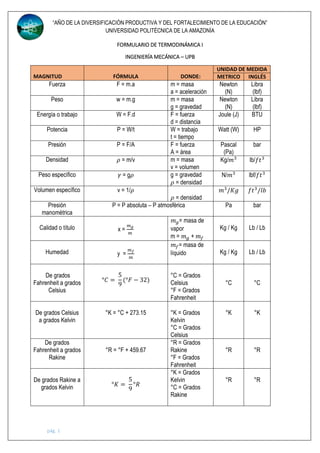
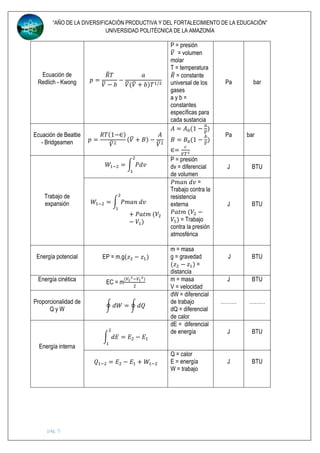
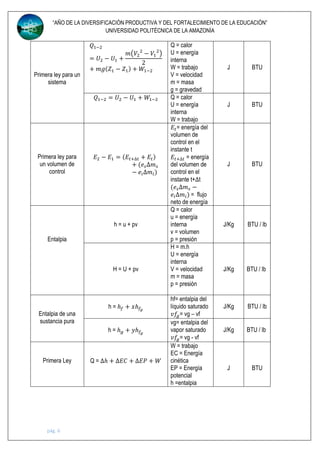
Este documento presenta una tabla de fórmulas y conceptos de termodinámica utilizados en ingeniería mecánica. La tabla incluye definiciones de unidades, fuerza, presión, temperatura, energía, trabajo, potencia y otras propiedades termodinámicas. También presenta ecuaciones de estado para gases ideales y no ideales, así como conceptos como entalpía, calor específico y la primera ley de la termodinámica. El documento proporciona esta información fundamental sobre termodinámica en 7 págin



![“AÑO DE LA DIVERSIFICACIÓN PRODUCTIVA Y DEL FORTALECIMIENTO DE LA EDUCACIÓN”
UNIVERSIDAD POLITÉCNICA DE LA AMAZONÍA
pág. 7
Primera ley para un
proceso de un
estado uniforme
𝑄 𝑉.𝐶. = [𝑚2 (𝑢2 +
𝑉2
2
2
+ 𝑔𝑍2)
− 𝑚1(𝑢1
+
𝑉1
2
2
+ 𝑔𝑍1)]
𝑉.𝐶.
Q = calor
u = energía
interna
V = velocidad
m = masa
p = presión
J BTU
Calor especifico a
volumen constante 𝐶𝑣 = (
𝜕𝑈
𝜕𝑇
)𝑉
U = energía
interna
V = volumen
T = temperatura
J BTU
Calor especifico a
presión constante 𝐶 𝑝 = (
𝜕ℎ
𝜕𝑇
)𝑝
h = entalpia
p = presión
T = temperatura
…….. ……..
Coeficiente de
Juole Thomson 𝜇 = (
𝜕𝑇
𝜕𝑃
) ℎ
h = entalpia
p = presión
T = temperatura
……. …….
TABLA I. UNIDADES DERIVADAS PARA LAS MAGNITUDES MAS USUALES
MAGNITUD UNIDAD
Área Metro cuadrado 𝑚2
Volumen Metro cubico 𝑚3
Velocidad Metro por segundo 𝑚/𝑠
Aceleración Metro por segundo al cuadrado 𝑚/𝑠2
Densidad Kilogramo por metro cubico 𝐾𝑔/𝑚3
Flujo de masa Kilogramo por segundo 𝐾𝑔/𝑠
Flujo volumétrico Metro cubico por segundo 𝐾𝑔3
/𝑠
Fuerza Newton N
Presión Pascal Pa
Energía, Trabajo, Calor Joule J
Potencia, flujo calorífico Watt W
Calor específico Joule por kilogramo – Kelvin J/Kg K
Entropía Joule por Kelvin J/K](https://image.slidesharecdn.com/formulariodetermodinmicaiautoguardado-151126221729-lva1-app6892/85/Formulario-de-termodinamica-I-7-320.jpg)



