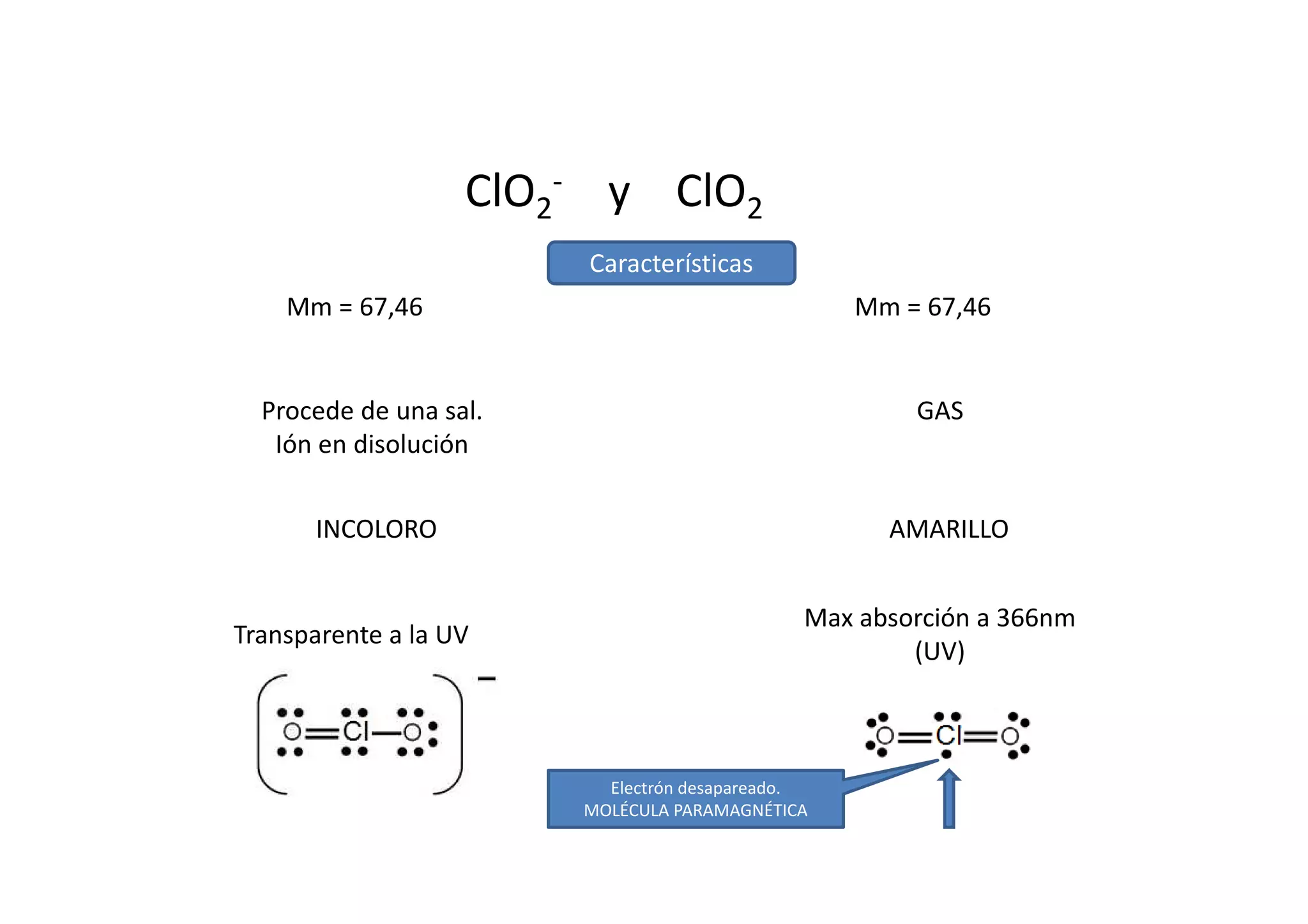
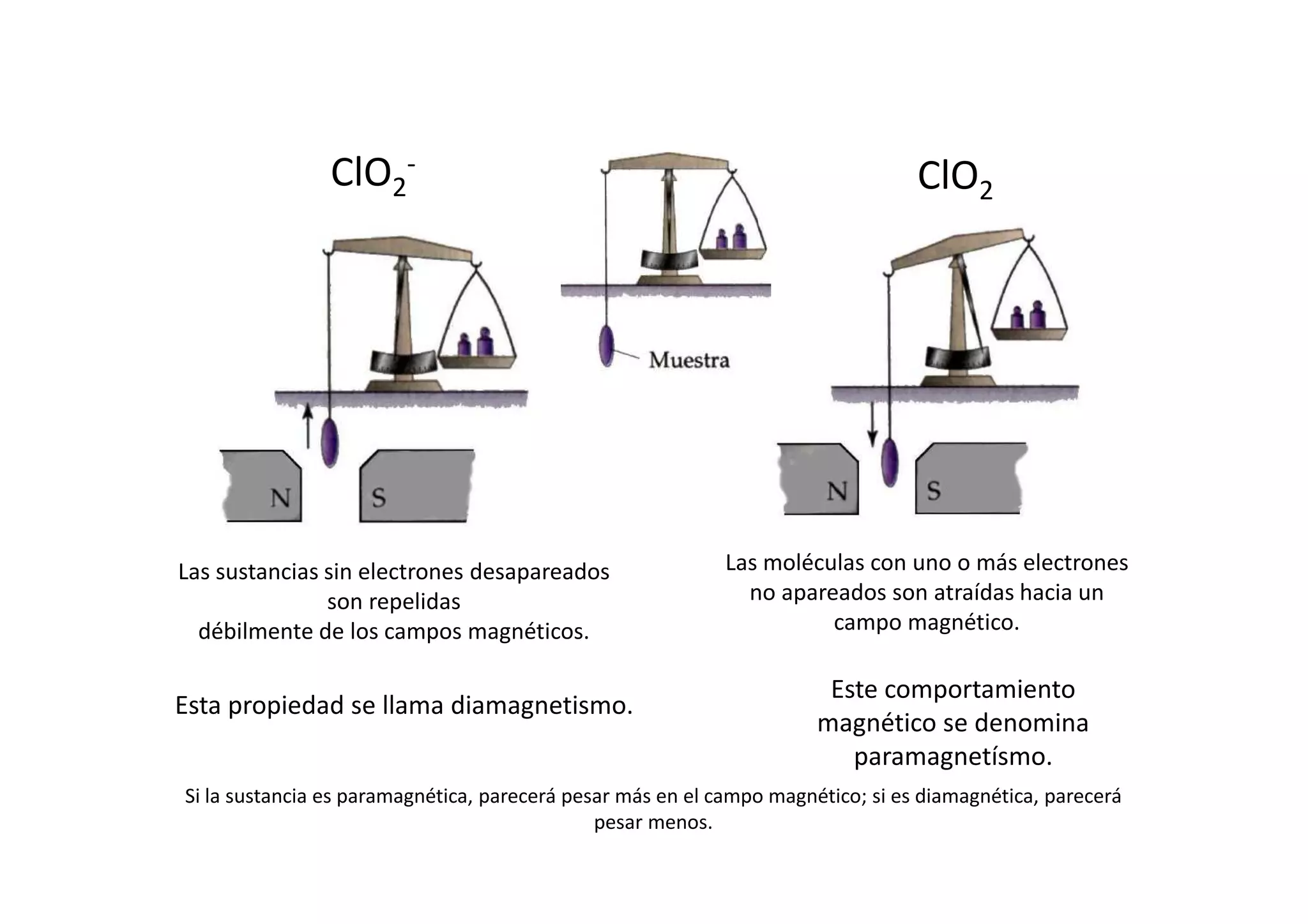
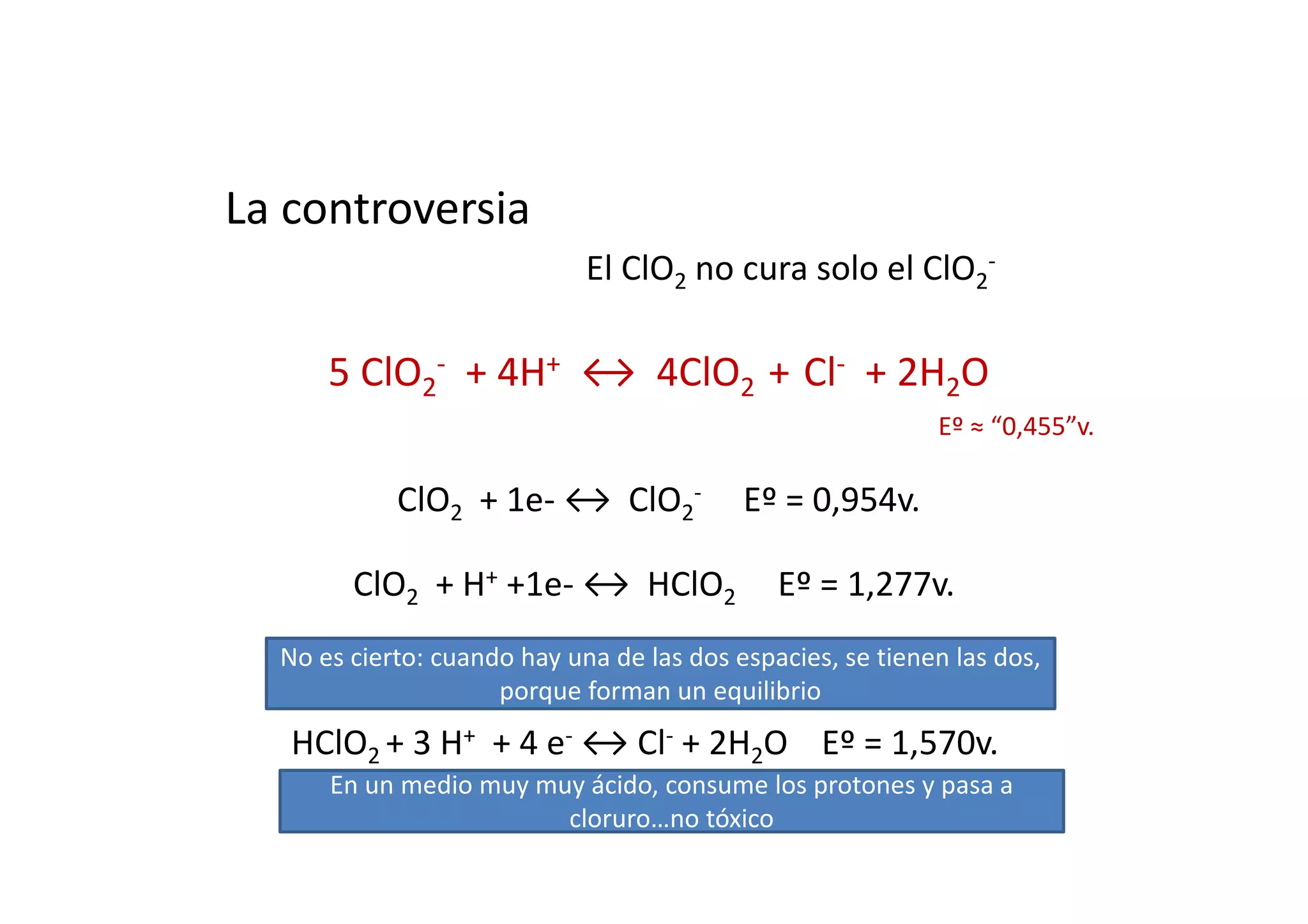
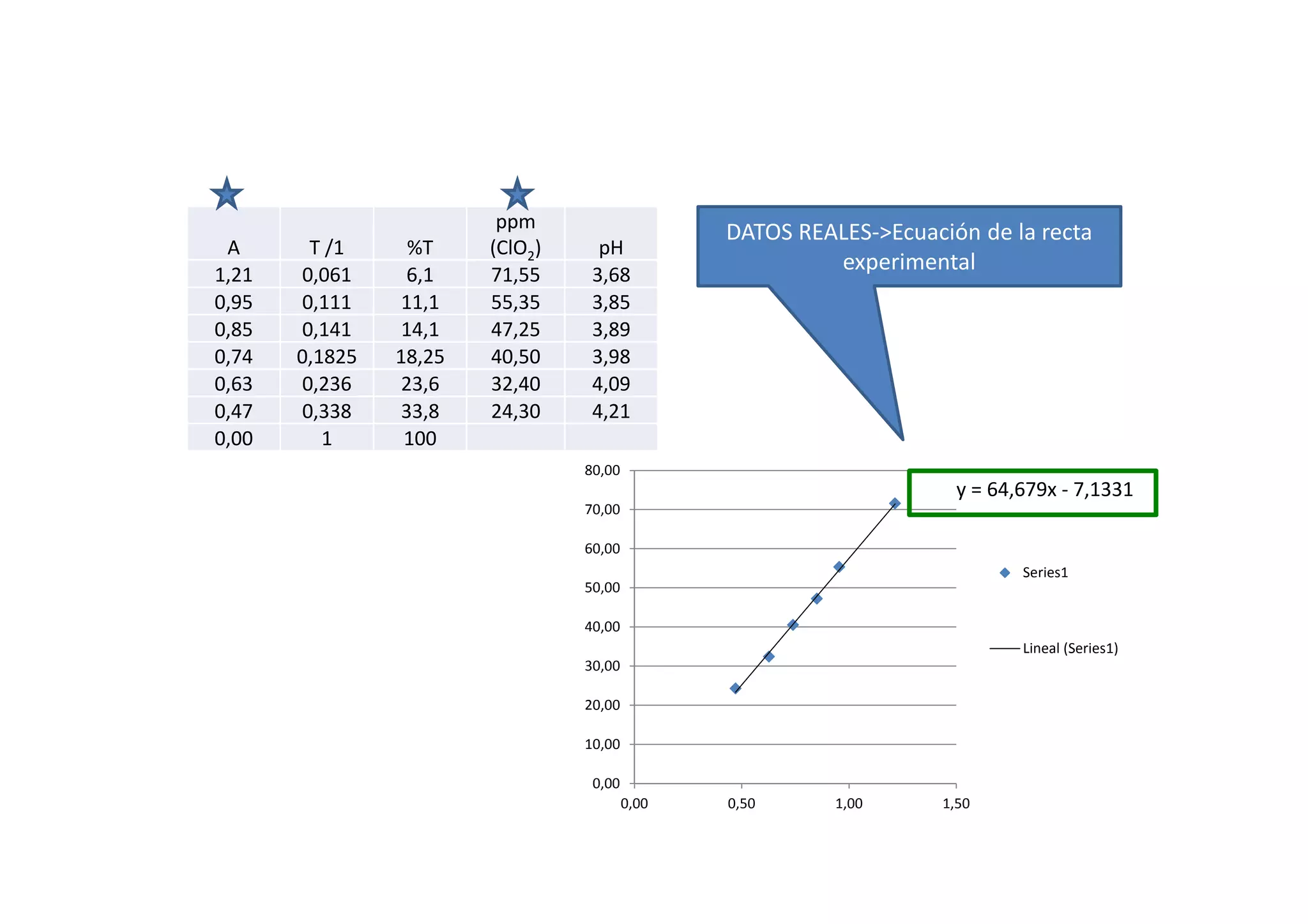
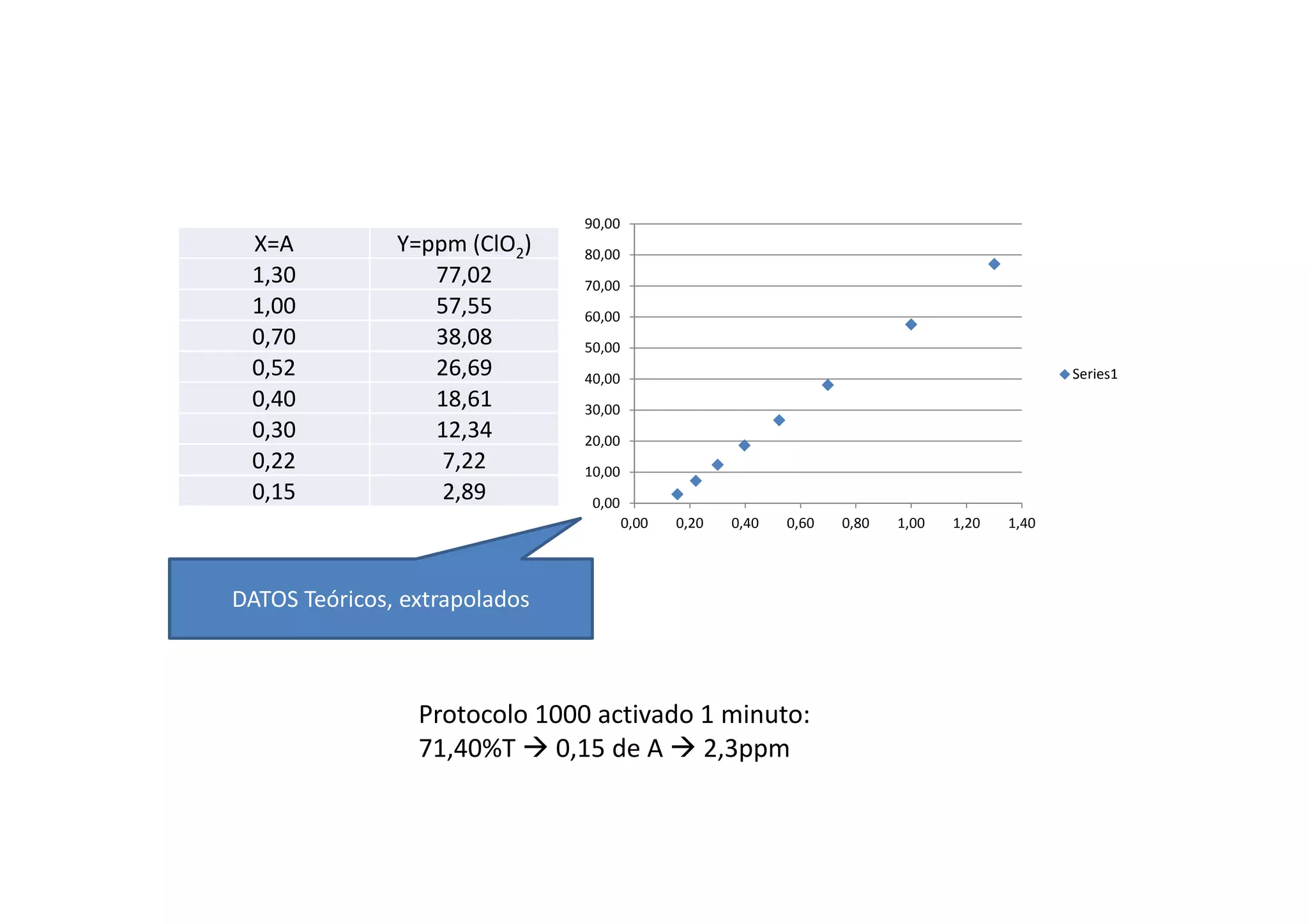
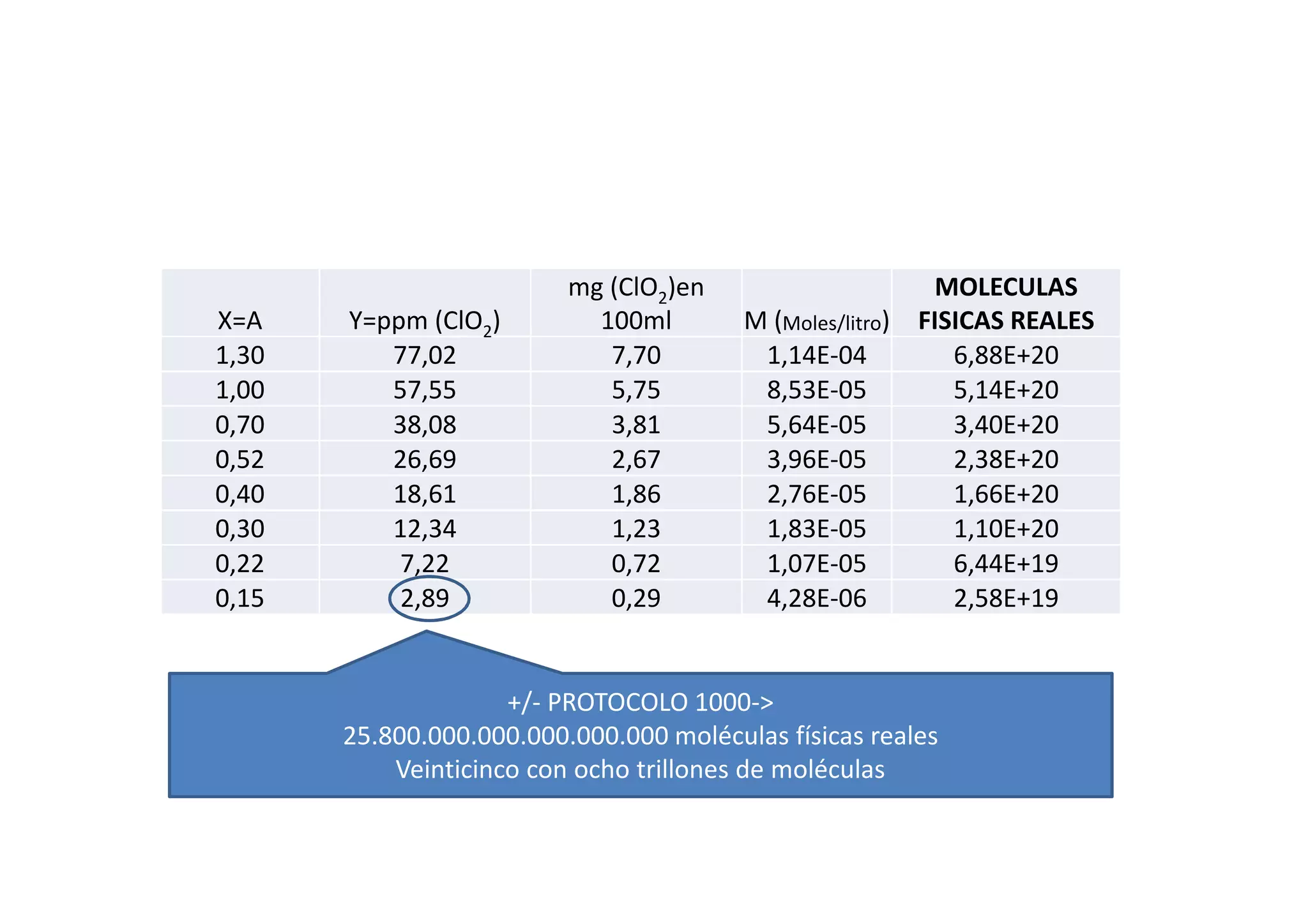
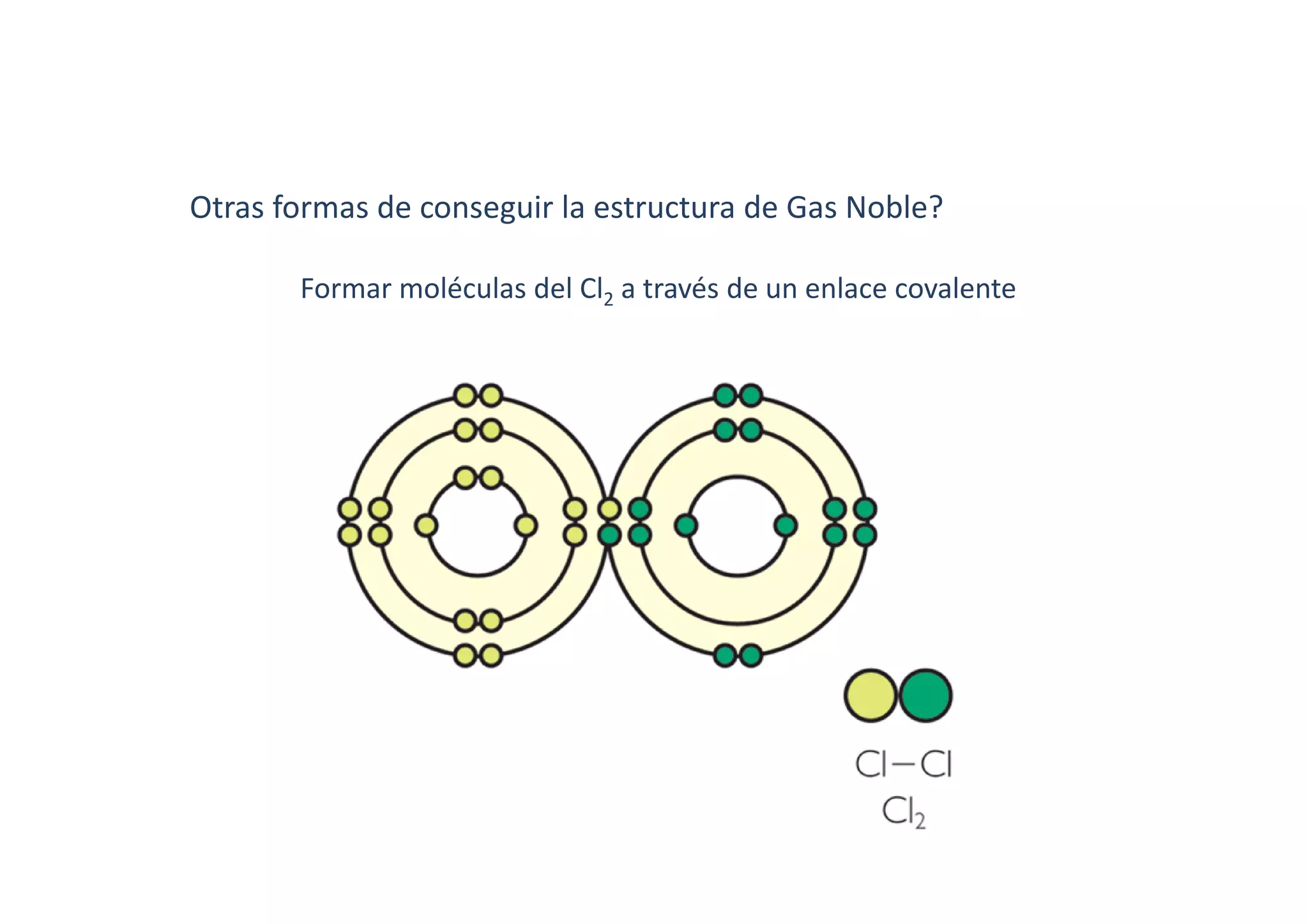
Este documento resume las propiedades del cloro, sus diferentes estados de oxidación y los compuestos que forma, incluyendo cloruros, cloritos, cloratos y percloratos. Explica la reacción de activación del clorito de sodio con ácido para producir dióxido de cloro gaseoso, y discute las controversias sobre esta reacción. El objetivo final es cuantificar las disoluciones de clorito y dióxido de cloro producidas.



















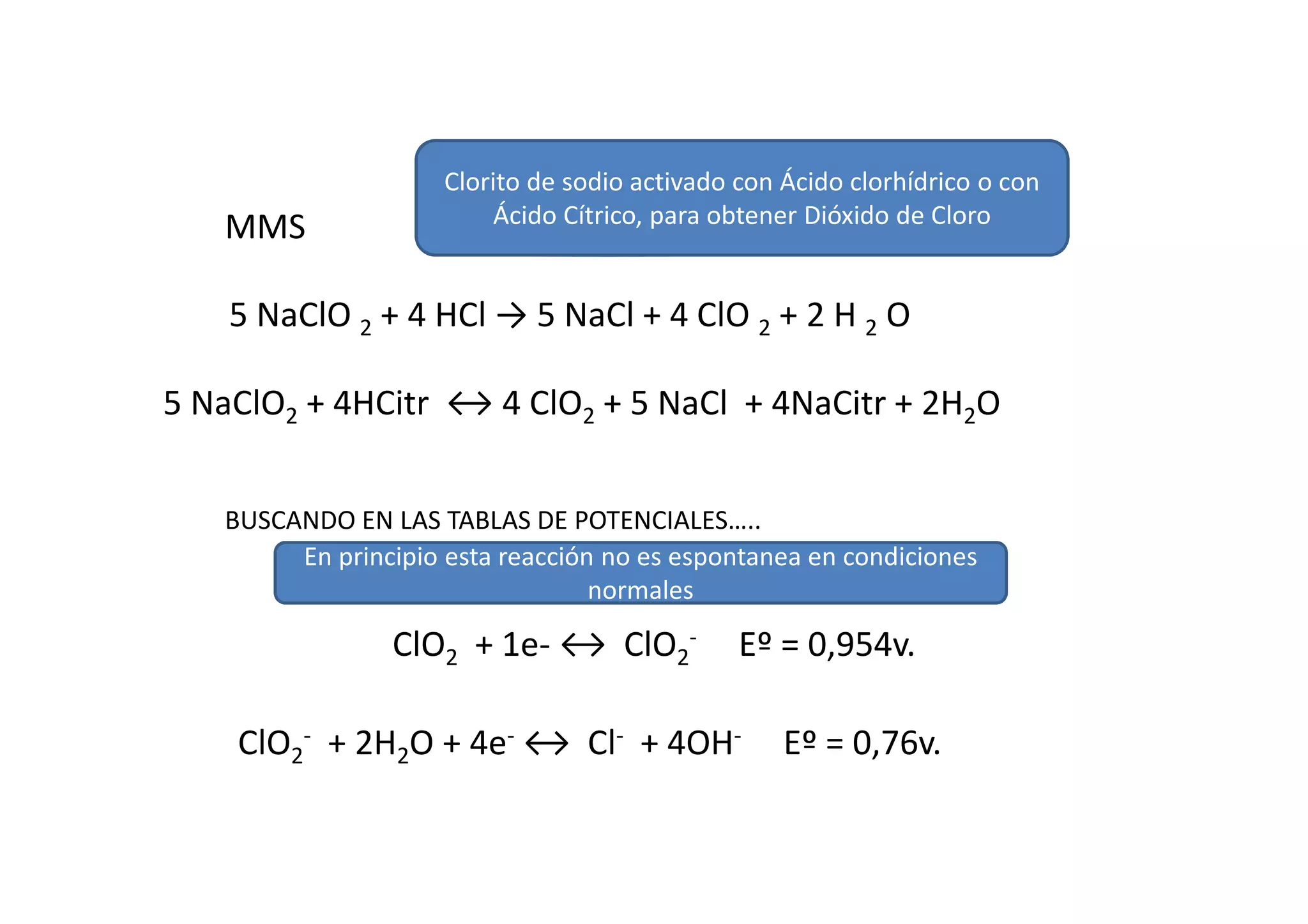


![ClO2 + 1e- ↔ ClO2
- Eº = 0,954v.
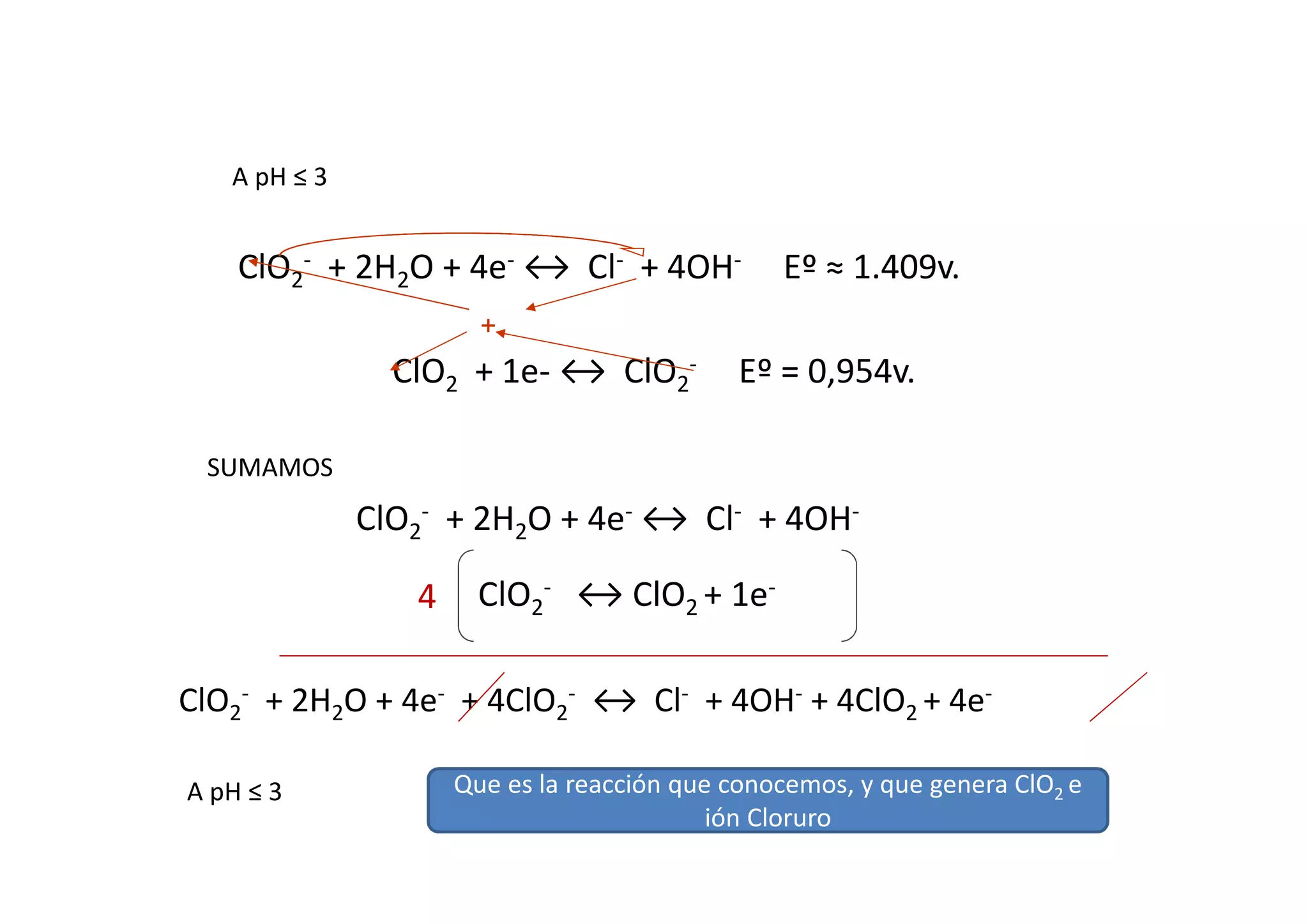
ClO2
- + 2H2O + 4e- ↔ Cl- + 4OH- Eº = 0,76v.
+
ClO2
- + 2H2O + 4e- ↔ Cl- + 4OH- Eº = 0,76v.
Ecuación de Nerst
E = E0 - 0.059/n log
[C ]c [D]d
[A]a [B ]b
pH = 3 pOH = 11
E = 0,76 - 0.059/4 log
[Cl-] [OH-]4
[ClO2
- ]
Potencial mas
positivo
Potencial menos
positivo
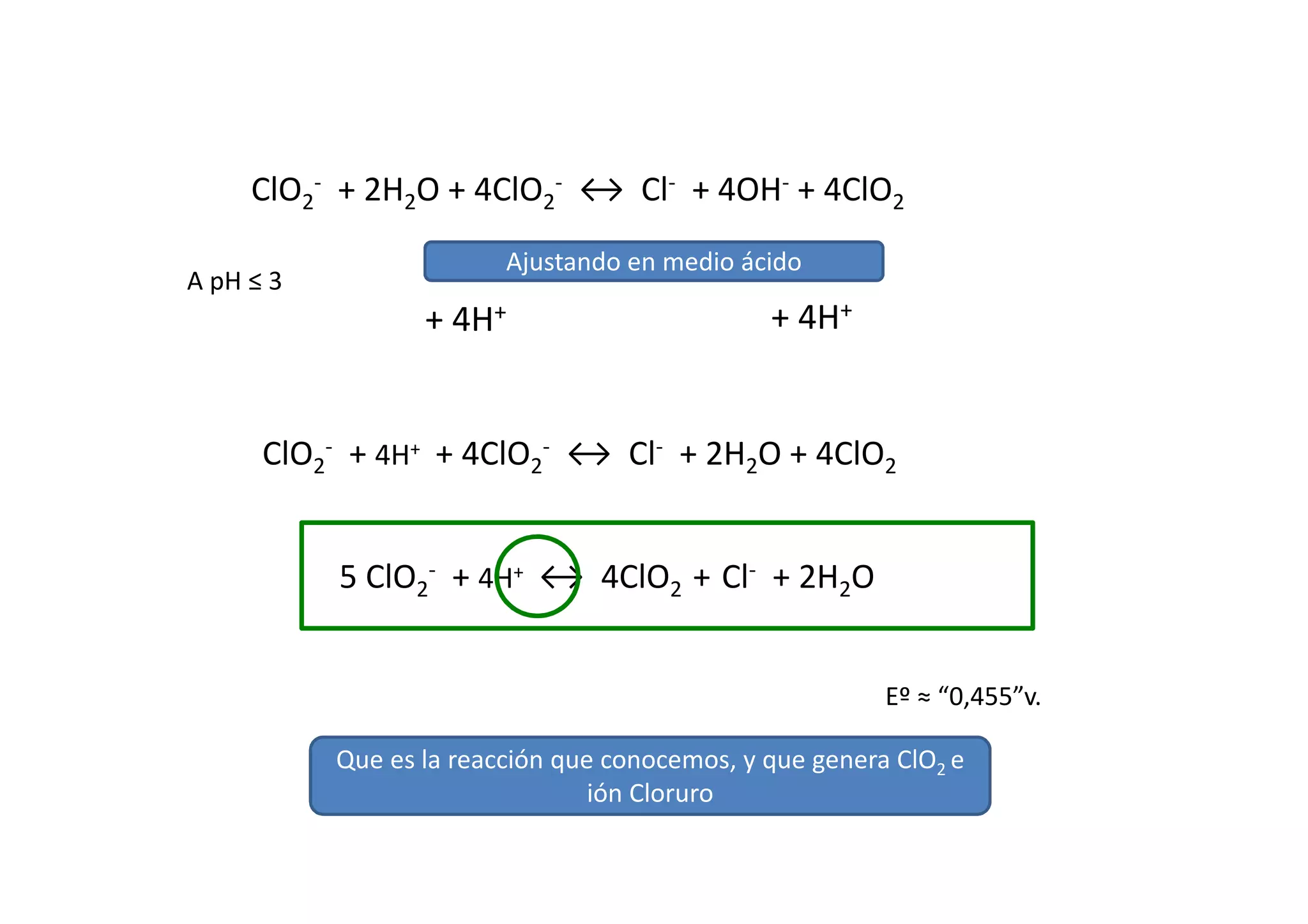
Esta reacción no es posible en condiciones estandar
Permite calcular el
potencial en las
condiciones de
cada sistema](https://image.slidesharecdn.com/qumicammsporrociolapuente-130725105924-phpapp01/75/Quimica-mms-por-rocio-lapuente-24-2048.jpg)
![pH = 3 pOH = 11
E = 0,76 - 0.059/4 log
[Cl-] [OH-]4
[ClO2
- ]
E = 0,76 - 0.059/4 log
[Cl-] [10-11]4
[ClO2
- ]
E = 0,76 + 0.649 log
[Cl-]
[ClO2
- ]
E = 1.409 v
Si [Cl-] = 10 [ClO2
- ]
Al activar en medio ácido, cambia el pH. Para las
condiciones estandar [OH-]= 1, en nuestro caso
particular es 11
Cambia la
situación….](https://image.slidesharecdn.com/qumicammsporrociolapuente-130725105924-phpapp01/75/Quimica-mms-por-rocio-lapuente-25-2048.jpg)