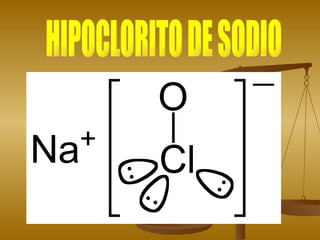
El documento describe las propiedades y usos del hipoclorito de sodio y el ácido clorhídrico. El hipoclorito de sodio es un compuesto químico blanqueador y desinfectante utilizado comúnmente como lejía. Puede causar quemaduras si entra en contacto con la piel o los ojos. El ácido clorhídrico es un líquido incoloro utilizado para limpiar metales y en la fabricación de productos. Es corrosivo y puede causar irritación si se ingiere, inhala o ent