Quimica 5 s - 3bim-
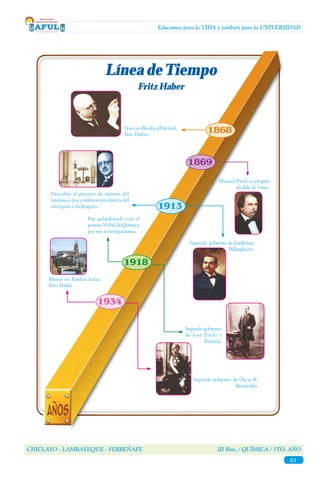
- 1. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 61 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo Fritz Haber Descubre el proceso de síntesis del amoniaco por combinación directa del nitrógeno e hidrógeno. Nace en Breslau (Polonia), Fritz Haber. Segundo gobierno de Guillermo Billinghurst. Manuel Pardo es elegido alcalde de Lima. 1869 1918 1868 1913 1934 Fue galardonado con el premio Nobel de Química por sus investigaciones. Segundo gobierno de José Pardo y Barreda. Segundo gobierno de Óscar R. Benavides. Muere en Basilea Suiza, Fritz Haber.
- 2. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 62 Educamos para la VIDA y también para la UNIVERSIDAD F.M. = F.E. x q para hallar q q = Es la determinación del porcentaje en masa de una sustancia en un compuesto o mezcla. Los alimentos presentan un informe nutricional en función de la composición centesimal. FÓRMULA MOLECULAR (F.M.) % parte = masa parte masa total x 100 Indica la composición centesimal del anhídrido sulfúrico SO3 . Se determina la masa molar del SO3 . ∑ % partes = 100% Azufre 1 x 32 = 32 + Oxígeno 3 x 16 = 48 M =80 g/mol % Azufre = x 100 = 40% % Oxígeno = x 100 = 60% 32 80 48 80 Es la verdadera fórmula de un compuesto químico. En ella se representa correctamente el número de átomos que forman a la molécula. FÓRMULA EMPÍRICA (F.E.) Es la fórmula más simple de un compuesto químico. Las dos fórmulas, molecular y empírica, poseen la misma composición centesimal. Compuesto F.M. F.E. q Tetróxido de nitrógeno Glucosa C6 H12 O6 CH2 O 6 N2 O4 NO2 2 M MFE Un hidrocarburo de masa molar igual a 30 g/mol contiene 80% de carbono y 20% de hidrógeno. Indica la fórmula molecular. Procedimiento: 1. Toma 100 g del compuesto. Carbono: 80 g; hidrógeno: 20 g 2. Averigua el Nº de at-g= Carbono = 6,67 at-g Hidrógeno = 20 at-g 3. Compara el Nº de at-g (divide con el menor valor obtenido) Carbono = 1 Hidrógeno = 2,99 4. Si los números son enteros o aproximadamente enteros, éstos se colocan en la fórmula empírica. F.E.: C1 H3 5. Se determina el valor de q y con ello la fórmula molecular. C1 H3 MFE = 12 + 3 = 15 g/mol Entonces q = = = 2 Luego la fórmula molecular es C1 H3 x 2 ⇒ C2 H6 masa P.A. 80 12 20 1 6,67 6,67 20 6,67 30 15 M MFE Composición Centesimal (C.C.) Ejemplo: Ejemplo:
- 3. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 63 Educamos para la VIDA y también para la UNIVERSIDAD Nivel I 1) CO2 I. Halla la composición de cada elemento presente en el compuesto. 8) C = 75% ; H = 25% II. Halla la fórmula empírica para: 2) N2 O5 3) H3 PO4 4) CaCO3 5) C6 H12 O6 6) H2 SO4 7) HNO3 9) N = 30,43% ; O = 69,57% 10) C = 40% ; H = 6,67% ; O = 53,33% 11) C = 82,76% ; H = 17,24% 12) C = 92,3% ; H = 7,7% III. Halla la fórmula empírica para las siguientes moléculas: 13) C6 H12 O6 14) C2 H6 15) C2 H2 16) Indicalacomposicióncentesimal del gas etano C2 H6 . a) %C = 80 ; %H = 20 b) %C = 75 ; %H = 25 c) %C = 50 ; %H = 50 d) %C = 60 ; %H = 40 e) %C = 40 ; %H = 60 Nivel II 17) Halla el porcentaje de agua en el compuesto de: Ca3 (PO4 )2 . 10 H2 O Masa atómica: Ca = 40, P = 31, O = 16, H = 1. a) 50% b) 62,5% c) 36,7% d) 40,8% e) 50,4% 18) Determina el porcentaje de carbono en el compuesto CH3 COOH. a) 40% b) 45% c) 50% d) 60% e) 75% 19) En el compuesto MgSOx existe 20% de magnesio. Indica el valor de x. Masa atómica (Mg = 24, S = 32, O = 16) a) 1 b) 2 c) 3 d) 4 e) 5 20) En la sal hidratada FeCl3 . x H2 O existe 43,67% de H2 O. Indica el valor de x. Masa atómica (Fe = 56; Cl = 35,5; H = 1; O = 16) a) 3 b) 4 c) 5 d) 6 e) 7 21) En el compuesto ZnS . x H2 O existe 34,76% de cinc. Señala la atomicidad del compuesto. a) 12 b) 13 c) 14 d) 16 e) 17 22) Un mineral de cobre contiene 70% de CuO. ¿Cuál es el porcentaje de cobre en el mineral? Masa atómica (Cu = 63,5; O = 16) a) 72% b) 65% c) 55,9% d) 60,3% e) 75,2% 23) Un mineral contiene 42% de hierro. ¿Cuál es el porcentaje de Fe2 O3 en el mineral? a) 40% b) 42% c) 50% d) 60% e) 72% 24) En el compuesto existe 50,95%dex.¿Cuáleselporcentaje de x en el siguiente compuesto? a) 76,2% b) 85,3% c) 60,5% d) 50% e) 40,7% x ? x x x
- 4. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 64 Educamos para la VIDA y también para la UNIVERSIDAD 25) EnlaespecieFeClx existe34,46% de hierro. Indica la atomicidad del compuesto. Masa atómica (Fe = 56; Cl = 35,5) a) 2 b) 3 c) 4 d) 5 e) 6 26) Un óxido contiene 48% de oxígeno y 52% de cromo. ¿Cuál es su fórmula empírica? Masa atómica (Cr = 52, O = 16) a) CrO b) Cr2 O3 c) CrO3 d) CrO2 e) Cr3 O4 27) Un hidrocarburo posee 81,82% de carbono y el resto de hidrógeno. Indica la fórmula empírica. a) CH3 b) CH4 c) C2 H5 d) C3 H8 e) C4 H9 28) Un hidrocarburo de masa molar de 58 g/mol contiene 82,76% de carbono. ¿Cuál es su fórmula molecular? a) C2 H6 b) C4 H8 c) C4 H10 d) C5 H12 e) C6 H6 29) Un compuesto contiene 44,44% de carbono; 6,18% de hidrógeno y 49,38% de oxígeno. Si la masa molar es 810 g/mol, indica la atomicidad del compuesto. a) 105 b) 121 c) 135 d) 109 e) 142 30) Al quemar un hidrocarburo Cx Hy se forma 0,5 mol de CO2 y 0,6 mol de H2 O. Indica el mínimo valor de “x + y”. a) 10 b) 12 c) 15 d) 17 e) 19 31) Halla la composición centesimal del gas metano CH4 . a) %C = 80 ; %H = 20 b) %C = 75 ; %H = 25 c) %C = 50 ; %H = 50 d) %C = 60 ; %H = 40 e) %C = 70 ; %H = 30 Nivel III 32) En el compuesto CaCOx existe 40% de calcio. Indica el valor de x. Masa atómica (Ca = 40; O = 16; C = 12) a) 1 b) 3 c) 5 d) 2 e) 4 33) EnlasalhidratadaMgSO4 xH2 O existe 60% de H2 O. Indica el valor de x. Masa atómica (Mg = 24, S = 32, O = 16, H = 1) a) 3 b) 5 c) 6 d) 7 e) 10 34) Un mineral de hierro contiene 60% de Fe2 O3 . ¿Cuál es el porcentaje de hierro en el mineral? Masa atómica (Fe = 56, O = 16) a) 42% b) 45% c) 52% d) 56% e) 58% 35) Un mineral contiene 32,5%. ¿Cuál es el porcentaje de CuSO4 en el mineral? Masa atómica (Cu = 63,5; S = 32; O = 16) a) 80,6 b) 81,6 c) 82,3 d) 83,7 e) 85,9 36) Una arcilla contiene 60% de arena y 20% de agua. Si la arcilla se seca, ¿cuál es el porcentaje de arena? a) 50% b) 60% c) 75% d) 80% e) 92% 37) Un óxido contiene 30,43% de nitrógeno si la masa molar es 92 g/mol. Indica la atomicidad del óxido. a) 4 b) 5 c) 6 d) 7 e) 8 38) Un compuesto orgánico posee la siguiente composición centesimal: Carbono 40%, hidrógeno 6,67% y oxígeno 53,33%. Si la masa molar es mayor que 150 g/mol pero menor que 192 g/mol, indica la fórmula molecular. a) C6 H10 O8 d) C10 H20 O10 b) C6 H12 O6 e) C5 H10 O8 c) C12 H22 O11 39) Unhidrocarburoposee82,76%de carbono y 17,24% de hidrógeno. Si la molécula del hidrocarburo posee 14 átomos, indica la masa molar del hidrocarburo. a) 30 g/mol d) 58 g/mol b) 42 g/mol e) 62 g/mol c) 50 g/mol 40) Al quemar un hidrocarburo se forma 13,2 g de CO2 y 7,2 g de H2 O. Indica la fórmula empírica del hidrocarburo. a) C2 H10 b) C3 H8 c) C2 H6 d) C5 H12 e) C7 H16
- 5. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 65 Educamos para la VIDA y también para la UNIVERSIDAD 41) En una mina se encontró una muestra de sal cálcica que pesaba 6,36 g y que contiene 2,55 g del metal. ¿Cuál de las siguientes es la muestra? Masas atómicas (Ca = 40; Cl = 35,5; O = 16; N = 14; S = 32; C = 12) a) Ca(ClO3 )2 d) CaCl2 b) Ca(NO3 )2 e) CaCO3 c) CaSO4 42) Un compuesto contiene 92,3% de C y 7,7% de H. La masa de un litro de dicho compuesto en condicionesnormalesesde1,165 g. Indica su fórmula molecular. a) C2 H2 b) C2 H4 c) C3 H6 d) C6 H6 e) C4 H10 43) Si el compuesto R contiene 2,98 g de carbono por gramo de hidrógeno, ¿cuál es la atomicidad de R? a) 4 b) 5 c) 6 d) 7 e) 8 44) Un compuesto que contiene C, H y O pesa 2,32g y por combustiónconeloxígenoforma 3,4 g de CO2 . Otra muestra del mismo compuesto que pesa 25 g libera 15 g de agua. Si la masa molar del compuesto es 180 g/mol, ¿cuántos átomos posee la molécula del compuesto? a) 18 b) 19 c) 20 d) 24 e) 30 45) La combustión de 2,8 litros de un compuesto gaseoso que contiene solamente carbono e hidrógeno requiere de 18,2 litros de oxígeno y produce 11,2 litros de CO2 y 11,25 g de H2 O. Si todos los gases se midieron a condiciones normales, indica la fórmula molecular del compuesto. a) C2 H6 b) C3 H8 c) C4 H10 d) C5 H12 e) C6 H14 46) Calcular el porcentaje de carbono en el etano C2 H6 . P.A. (C = 12; H = 1) a) 60% b) 75% c) 80% d) 25% e) 49% 47) Señalalacomposicióncentesimal del ácido sulfúrico. P.A. (H = 1; S = 32) a) 30% H ; 70% S b) 20% H ; 10% S ; 70% O c) 5,88% H ; 20,12% S ; 74% O d) 5,88% H ; 94,112% S e) 50% H ; 50% S 48) Determina el porcentaje de agua en el sulfato de magnesio dihidratado (M = 156 g/mol). a) 23,07% d) 76,93% b) 46,15% e) 53,85% c) 92,3% 49) Un mineral contiene 90% de Fe2 O3 . ¿Cuál es el porcentaje de hierro en el mineral? P.A. (Fe = 56; O = 16) a) 70% b) 60% c) 63% d) 75% e) 82% 50) Unos huesos que pesan 6 kilogramos contienen 75% de fosfato de calcio. ¿Qué peso de fósforo existe en los huesos? P.A. (Ca = 40; P = 31; O = 16) a) 0,9 kg d) 1,25 kg b) 4,5 kg e) 2,7 kg c) 1,75 kg El filósofo griego Aristóteles pensaba que las sustancias estaban formadas por cuatro elementos: tierra, aire, agua y fuego. Paralelamente discurría otra corriente paralela, el atomismo, que postulaba que la materia estaba formada de átomos, partículas indivisibles que se podían considerar la unidad mínima de materia. Esta teoría, propuesta por el filósofo griego Demócrito de Abdera no fue popular en la cultura occidental dado el peso de las obras de Aristóteles en Europa. Sin embargo tenía seguidores (entre ellos Lucrecio) y la idea se quedó presente hasta el principio de la Edad Moderna.
- 6. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 66 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo GlennTheodore Seaborg Dirige la Comisión de energía atómica de los EE.UU. Nace en Michigan (EE.UU), Glenn Seaborg. Gobierno de Manuel Prado Ugarteche. Guerra con el Ecuador. 1942 1967 1999 1961 1941 1977 1946 Gobierno de José Luis Bustamante y Rivero. Dirige la investigación sobre física y química nuclear relacionada con el proyecto “Manhattan”. La IUPAC anuncia que el elemento 106 de la tabla periódica llevaría el nombre de Seaborgium. Fallece Glenn Seaborg en Berke- ley (EE.UU). 1912 Gobierno de Alberto Fujimori. Gobierno de Francisco Morales Bermúdez. Primer gobierno de Fernando Belaúnde Terry. Inicio del gobierno de Billinghurst.
- 7. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 67 Educamos para la VIDA y también para la UNIVERSIDAD Personaje del Tema Los gases se caracterizan porque sus moléculas se mueven al azar en todas las direcciones, motivadas por su elevada energía cinética. Una gran cantidad de reacciones químicas ocurren en el estado gaseoso, así el hidrógeno y el oxígeno gaseosos activados por una chispa eléctrica reaccionan formando agua; similarmente el hidrógeno y nitrógeno para formar amoniaco. Por otro lado, muchas sustancias gaseosas intervienen en procesos como: combustión, motores de explosión interna, aire atmosférico, gases contaminantes y tantos otros que hacen una necesidad conocer sus propiedades y leyes que los rigen. PROPIEDADES DE LOS GASES Los gases no presentan forma propia, sino que se adaptan la fórmula del recipiente que los contiene. Una vez que cesa la causa deformadora, los gases tratan de recuperar sus dimensiones originales. 3. Elasticidad 2. Fluidez Las moléculas del gas se mueven ocupando todo el volumen del recipiente que lo contiene o volumen disponible. 1. Expansibilidad Eselfenómenoporelcuallasmoléculasdeungassedistribuyenuniformemente, en otro gas. También es la capacidad de las moléculas gaseosas para pasar a través de aberturas pequeñas. 4. Difusibilidad Los gases pueden disminuir sus dimensiones con mucha facilidad por el efecto de la presión. 5. Compresibilidad Se comprime Debido a la presión El émbolo tratará de retornar al dejarse de presionar Jan Baptist van Helmont Químico, fisiólogo y médico belga que reconoció la existencia de gases discretos e identificó el dióxido de carbono. Puede considerarse a Jan Baptist van Helmont como puente entre la alquimia y la Química, aunque con inclinaciones místicas y creyentes de la piedra filosofal. Fue un observador cuidadoso y un experimentador exacto. 1577: Nació en Bruselas. 1644: Murió en la actual Bélgica. • Inventó la palabra “gas” (del griego caos). • Cultivó un árbol, al cual lo plantó en la tierra y utilizó el agua como elemento principal de la química. • Algunos lo llamaron el padre de la Bioquímica. Estado Gaseoso I
- 8. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 68 Educamos para la VIDA y también para la UNIVERSIDAD V1 = 4 L V2 = 8L T1 = 300 K T2 = 430 K P1 = 2 atm P2 = ? P2 = 1,43 atm LEY UNIVERSAL DE LOS GASES Se aplica a cualquier masa gaseosa, e implica a las variables de estado de un gas (presión (P), volumen (V) y temperatura (T) ) ; las medidas de estas magnitudes nos da información sobre la condición física en la que se halla un gas. En la Ley Universal se cumple que el producto de su presión absoluta y volumen, es igual al producto de su número de moles por la constante universal y su temperatura absoluta. Donde: P → Presión V → Volumen n → Número de moles T → Temperatura R → Constante universal Variables de Estado (Presión, Volumen y Temperatura) PV = RTn R = 62,4 ;R = 0,082 ; 10,8 lb / pulg2 . pie3 mol - lb . °R R = atm . L mol - g . K mmHg . L mol - g . K Ejemplo: ¿Cuál es el volumen de 2 moles de gas hidrógeno a la temperatura de 127º C y 4,1 atm? Solución: P = 4,1 atm T = 400 K n = 2 R = 0,082 V = ? PV = RTn V = (0,082)(400)(2) 4,1 RTn P = = 16 litros LEY GENERAL DE LOS GASES Ecuación general: Donde: P1 y P2 : Presiones absolutas, inicial y final. T1 y T2 : Temperaturas absolutas, inicial y final. V1 y V2 : Volúmenes absolutos, inicial y final. P1 V1 T1 = P2 V2 T2 Ejemplo: Cuatro litros de un gas a 27º C y 2atm de presión se calientan hasta 157º C siendo su volumen de 8 litros. ¿Cuál será la presión final? Solución: P1 V1 T1 P2 V2 T2 = P1 V1 T2 T1 V2 P2 = (2)(4)(430) (300)(8) = En el campo de concentración de Auschwitz, construido por los nazis en las inmediaciones de la aldea de Oswiecim, se ensayó el método de la gasificación para eliminar en masa a un número considerable de víctimas judías. En Auschwitz perdieron la vida unas cuatro millones de personas, a razón de ‘‘dos mil cadáveres cada 12 horas’’, según informes de los ‘‘técnicos’’ por la aplicación del famoso gas ‘‘Zyklon - B’’, que no es otra cosa que ácido cianhídrico HCN, un veneno para matar ratas.
- 9. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 69 Educamos para la VIDA y también para la UNIVERSIDAD Rpta.: 12,5 moles 1. ¿Cuál será el número de moles de un gas que se encuentra en un balón de 10 L de capacidad, a una presión de 41 atm y una temperatura de 127º C? Resolución: n = ? V = 10 L P = 41 atm T = 127º C R : Constante universal de los gases ideales. Como la presión está en atm, se utilizará el valor de 0,082. Luego: Para resolver este tipo de problemas se utilizará la ecuación general de los gases ideales PV = nRT. La temperatura está en grados celsius, luego la convertiremos a grados Kelvin. 127 + 273 = 400 K P. V = n . R . T →n = P . V R . T 41 x 10 0,082 x 400 n = V = ? n = ? P = 25,4 atm T = 37º C R = 0,082 Luego: P.F. (CH4 ) = 1C + 4H = 1(12) + 4(1) = 16 g/mol Entonces: Observamos que la temperatura está en grados celsius y la transformaremos a kelvin. → 37 + 273 = 310 K Luego: En la ecuación PV = nRT → 25,4 x V = 5 x 0,082 x 310 V = Notamos que para hallar el volumen con la ecuación PV=nRT nos está faltando n; pero sabemos que el número de moles se puede calcular de la siguiente manera: 2. Determina el volumen que ocupa 80 g de CH4 a 37º C y 25, 4 atm de presión.P.A. (C = 12 , H = 1) Resolución: n = 80 16 → n = 5 moles n = W P.F. Donde: W : Masa P.F. : Peso fórmula atm . L mol - g . K 5 x 0,082 x 310 25,4 Rpta.: 5,00 L El hidrógeno es un elemento gaseoso cuyo empleo más importante es la síntesis del amoniaco. La utilización del hidrógeno está aumentando con rapidez en las operaciones de refinación del petróleo, como el rompimiento por hidrógeno (Hydrocracking) y en el tratamiento con hidrógeno para eliminar azufre. Se consumen grandes cantidades de hidrógeno en la halogenación catalítica de aceites vegetales líquidos insaturados para obtener grasas sólidas. La hidrogenación se utiliza en la manufactura de productos químicos orgánicos. Grandes cantidades de hidrógeno se emplean como combustible de cohetes, en combinación con oxígeno o flúor, y como un propulsor de cohetes impulsados por energía nuclear.
- 10. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 70 Educamos para la VIDA y también para la UNIVERSIDAD Rpta.: 12,3 atm 3. Si 30,1 x 1023 moléculas de SO3 ocupan un volumen de 10 L a 27º C. halla la presión que ejerce en atmósferas. P.A. (S = 32; O = 16) Resolución: P = ? V = 10 L T = 27º C n = ? R = 0,082 Sabemos que: 1 mol de SO3 → 6,02 x 1023 moléculas de SO3 Entonces: 1 mol de SO3 → 6,02 x 1023 moléculas de SO3 n moles de SO3 → 30,1 x 1023 moléculas de SO3 n = 5 moles Luego: Conociendo ‘‘n’’ utilizamos la ecuación PV = nRT. → P(10) = (5)(0,082)(300) P = Primero hallamos la temperatura en Kelvin: → 27 + 273 = 300 K Luego para hallar la presión es necesario conocer el número de moles ‘‘n’’. → n = 30,1 x 1023 x 1 6,02 x 1023 moles 5 x 0,082 x 300 10 atm . L mol - g . K Rpta.: 44,8 L 4. Halla el volumen de 60 g de gas etano C2 H6 a C.N. P.A. (C = 12 , H = 1) Resolución: Sabemos que 1 mol de cualquier gas a condiciones normales ocupa un volumen de 22,4 litros: Luego hallando ‘‘n’’: como ; entonces P.F. = 2(12) + 6(1) = 30 g/mol → n = → n = 2 moles Entonces: 1 mol C2 H6 → 22,4 L x = L 2 moles C2 H6 → x L 60 30 22,4 x 2 1 → C.N. 1 mol (C2 H6 ) → 22,4 L n moles (C2 H6 ) → x L n = W P.F. W M Rpta.: 3,902 g/L 5. Calcula la densidad del gas metano (CH4 ) a una temperatura de 127ºC y 8 atm de presión. P.A.(C = 12; H = 1) Resolución: Para resolver este problema utilizaremos la ecuación universal de los gases PV = nRT. Pero como interviene la densidad y sabemos que D = W/V, entonces: P.V = nRT P.V = R.T → P.M = R.T Luego: Los datos que tenemos son: P = 8 atm T = 127º C R = 0,082 D = ? M(CH4 ) = 1(12) + 4(1) = 16g/mol Entonces: En la fórmula: P . M = D . R . T 8 x 16 = D x 0,082 x 400 D = 8 x 16 0,082 x 400 W V Nivel I 1) Determina el volumen ocupado por 2 moles a 527º C y 8,2 atm. a) 14 L b) 16 L c) 8 L d) 15 L e) 4 L 2) Determina el volumen ocupado por 2 moles a 127º C y 8,2 atm. a) 16 L b) 14 L c) 12 L d) 10 L e) 8 L atm . L mol-g.k
- 11. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 71 Educamos para la VIDA y también para la UNIVERSIDAD 16) Cuando la presión se duplica el volumen se reduce a la tercera parte. ¿Qué sucede con la temperatura? a) Disminuye en 2/3 b) Aumenta en 2/3 c) Disminuye en 1/3 d) Aumenta en 1/3 e) No varía Nivel II 10) Determina el volumen ocupado por 0,5 g de gas hidrógeno a 527ºC y a 124,8 mmHg. a) 40 L b) 60 L c) 80 L d) 100 L e) 150 L 3) Un gas ocupa 6 L a 27º C y 5 atm. ¿Qué volumen ocupa a 8 atm y 127º C? a) 2 L b) 3 L c) 4 L d) 5 L e) 6 L 4) Un gas ocupa 5 L a 227º C y 3 atm. ¿Qué presión ejerce en un recipiente de 6 L a 27º C? a) 1 atm d) 2,5 atm b) 1,5 atm e) 4 atm c) 2 atm 5) No es variable fundamental del estado gaseoso. a) Presión d) Volumen b) Temperatura e) Todas c) Densidad 6) Para un mol de gas. ¿cuál es la relación más probable, según la ecuación universal, para determinar el volumen de un gas? a) V = Pn/RT b) V = Rn/nT c) V = RT/P d) V = RPT e) V = P/RT 7) Determina la presión en mmHg de 3 moles de gas a 527º C si ocupa un volumen de 3,12 litros. a) 3,2 b) 48 000 c) 4,8 d) 480 e) 32 000 8) Determina la presión de 10 g de gas hidrógeno que ocupa un volumen de 12,5 L a una temperatura de 227º C. a) 16,4 atm d) 32,8 atm b) 8,2 atm e) 4 atm c) 4,1 atm 9) Determina el volumen de 2 moles de gas a 527º C y 16,4 atm. a) 2 L b) 4 L c) 6 L d) 8 L e) 10 L 11) Determina el volumen ocupado por 80 g de gas metano a 327º C y a 16, 4 atm. a) 15 L b) 20 L c) 30 L d) 45 L e) 60 L 12) Cierta masa de gas se encuentra a la presión de 2 atm y la temperatura de 27º C, ocupando un volumen de 30 L. ¿Cuál será el volumen que ocupa el gas si la temperatura a cambiado a 127º C y la presión es de 4 atm? a) 2 L b) 20 L c) 10 L d) 0,1 L e) 0,2 L 13) Se tiene 400 ml de un gas ideal a 27º C y 1 atm. Si se cuadruplica su volumen a igual presión, determina la nueva temperatura. a) 120 K b) 12 K c) 1200 K d) 140 K e) 1400 K 14) Al disminuir el volumen de un gas en un 40% y aumentar su temperatura en 50%, ¿en cuánto excede la presión final a la inicial en porcentaje? a) 10% b) 20% c) 30% d) 40% e) 50% 15) Si la presión aumenta en 20% y el volumen disminuye en 25%, ¿qué sucede con la temperatura? a) Aumenta 90% b) Disminuye 90% c) Aumenta 10% d) Disminuye 10% e) No varía 17) Un recipiente contiene 100 mol - g de un gas desconocido a 273 atm y 0º C. ¿Qué volumen ocupará dicho gas? a) 82 L b) 0,82 L c) 20 L d) 8,2 L e) 40 L 18) Determina la masa de 20 L de CH4 a 41 atm y 73º C. a) 900g b) 100 g c) 800 g d) 200 g e) 150 g 19) ¿Qué masa presenta un recipiente de 298 ml con CO2 a 25º C y a 1,23 atm? a) 0,4 g b) 0,8 g c) 1, 3 g d) 6, 2 g e) 0, 6 g
- 12. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 72 Educamos para la VIDA y también para la UNIVERSIDAD 31) Halla el número de moles de un gas, sabiendo que se encuentra encerrado en un recipiente de 8 L a la presión de 0,82 atm y a una temperatura de 127º C. a) 1 mol d) 4 moles b) 0,2 moles e) 5 moles c) 2 moles Nivel III 20) Calcula el peso molecular (M) de una sustancia gaseosa que se encuentra a 4,1 atm y 127ºC ocupando un volumen de 14 litros. a) 16 g/mol d) 32 g/mol b) 14 g/mol e) 64 g/mol c) 28 g/mol 21) Se tiene 320 g de gas oxígeno a 27º C y en un recipiente de 624 L de capacidad. Determina la presión en mmHg ejercido por el gas. a) 100 b) 200 c) 300 d) 400 e) 500 22) Una masa de oxígeno (O2 ) ocupa 30 ml a 27º C. Halla el volumen en cm3 a 127ºC si se cumple que la presión se mantiene constante. a) 40 b) 20 c) 30 d) 10 e) 80 23) Calcula el volumen que ocupará una mol de un gas a 0º C y 760 mmHg. a) 11, 2 L b) 22, 4 L c) 1, 0 L d) 5, 6 L e) 12, 3 L 24) Determina el volumen ocupado por 3 moles de gas a condiciones normales. a) 67,2 L b) 66,2 L c) 44,8 L d) 22, 4 L e) 11,2 L 25) Halla la densidad de un gas que presenta 4,1 atm y 127º C, M = 16 g/mol. a) 1 g/L b) 2 g/L c) 4 g/L d) 8 g/L e) 16 g/L 26) ¿Qué volumen ocupará 2 moles de oxígeno (O2 ) a 127º C y 1 atmósfera? (R = 0,082) a) 65,6 L b) 22,4 L c) 44,8 L d) 131,2 L e) N.A. 27) El volumen molar (en litros) de un gas ideal a 93º C y 0,75 atm es: (Vmolar = V/n = RT/P) a) 35 b) 40 c) 45 d) 50 e) 25 28) Halla el número de moles de un gas, sabiendo que se encuentra encerrado en un recipiente de 3 litros a la presión de 0,82 atm y a la temperatura de 27º C. a) 1 mol b) 0,1 mol c) 2 mol d) 4 mol e) 5 mol 29) Determina la densidad del gas metano (CH4 ) en g/l a 4,1 atm y 127º C. a) 1 b) 1,5 c) 2 d) 2,5 e) 2,6 30) Calcula la masa que presenta un recipiente de 6 L con NH3 a 1,64 atm y 27º C. a) 1,4 g b) 2,8 g c) 6,8 g d) 13,6 g e) 22,8 g 32) Calcula el volumen molar de N2 a 16,4 atm y 127º C. a) 2 L/mol d) 4 L/mol b) 0,002 L/mol e) N.A. c) 0,04 L/mol 33) Una muestra de gas puro a 27º C y 380 mmHg ocupa un volumen de 493 L. ¿Cuál es el número de moles de la muestra? a) 1 b) 2 c) 5 d) 10 e) N.A. 34) Un volumen de 31,2 L de un gas medido a 85º C y 358 mmHg pesa 3,86 g. Entonces el peso molecular del gas es: a) 7,72 g/mol d) 79,2 g/mol b) 3,86 g/mol e) N.A. c) 38,6 g/mol 35) El gas C3 H8 ocupa un volumen de 20 L a una temperatura de 27º C y a una presión de 8,2 atm. Calcula la cantidad de moles de dicho gas. a) 3 b) 5 c) 10 d) 15 e) 30 36) Determina la presión del NO2 si se tiene los siguientes datos: NO2 , V = 30 L, W = 460 g, T = 27º C. a) 82 atm d) 1,64 atm b) 8,2 atm e) 164 atm c) 16,4 atm
- 13. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 73 Educamos para la VIDA y también para la UNIVERSIDAD 37) Se tiene 2 recipientes de igual capacidad a las mismas condiciones de presión y temperatura. Si en uno de ellos se encuentra 0,3 x 1024 moléculas de gas “x” y en el otro oxígeno, calcula el peso de oxígeno en el recipiente. a) 32 g b) 48 g c) 8 g d) 20 g e) 16 g 39) ¿Qué volumen ocupa 128 gramos de gas O2 a 127º C y 1 atmósfera? a) 22,4 L b) 65,6 L c) 44,8 L d) 131,2 L e) N.A. 38) ¿Qué cantidad de CO2 debe estar contenido en un recipiente de 40 L de capacidad a una temperatura de 127º C y a 624 mmHg? a) 1 g b) 3 g c) 28 g d) 44 g e) 60 g 40) Determina la densidad del metano (CH4 ) a una presión de 780 mmHg y a una temperatutra de 127º C. a) 0,5 g/L b) 0,3 g/L c) 1 g/L d) 1,5 g/L e) 2 g/L 41) Se producen 112 ml de gas acetileno (C2 H2 ) a 77º C y 750 mmHg de presión. ¿Cuál es su masa en gramos? P.A. (C = 12, H = 1) a) 10 g b) 100 g c) 0,1 g d) 0,01 g e) N.A. 42) ¿Cuántas moles contiene cierta cantidad de gas a una presión de 1248 mmHg, a una temperatura de 127º C y un volumen de 400 L? a) 5 b) 10 c) 15 d) 20 e) 25 43) Un gas se encuentra a 8,2 atm, 27º C y ocupa un volumen de 300 L. Determina la cantidad de moles de dicho gas. a) 20 b) 50 c) 80 d) 100 e) 120 44) ¿Cuál es la masa de 624 L de gas butano (C4 H10 ) que se encuentra a una temperatura de 27º C y a una presión de 900 mmHg? a) 105 g b) 124 g c) 1740 g d) 1550 g e) 2510 g 45) Calcula la densidad del metano (CH4 ) a 27º C y 8,2 atm. a) 3,3 g/L b) 5,3 g/L c) 9,3 g/L d) 13,3 g/L e) 16 g/L 46) Determina la cantidad de átomos presentes en 4 L de gas amoniaco (NH3 ) a 527º C y 16,4 atm. (No: Número de Avogadro) a) No b) 10 No c) 4 No d) 40 No e) 50 No 47) Halla el volumen que ocupa un gas que tiene una presión de 0,41 atm, T = 27º C y 2 moles. a) 12 L b) 1,2 L c) 0,12 L d) 122 L e) 120 L 48) No es considerada variable fundamental del estado gaseoso. a) Presión b) Volumen c) Densidad d) Temperatura e) To d a s s o n v a r i a b l e s fundamentales 49) Halla las moles que ocupa un gas con 0,41 atm; una capacidad de 2 L y se encuentra a una temperatura de 77º C. a) 0,011 moles b) 0,028 moles c) 0,033 moles d) 0,044 moles e) 0,066 moles 50) Determina la densidad del CO2 a 4 atm y 127º C. a) 5,4 g/l d) 4,4 g/l b) 3,4 g/l e) 6,4 g/l c) 2,4 g/l La ciencia química surge en el siglo XVII a partir de los estudios de alquimia populares entre muchos de los científicos de la época. Se considera que los principios básicos de la química se recogen por primera vez en la obra del científico británico Robert Boyle: The skeptical chymist (1661). La química como tal comienza sus andares un siglo más tarde con los trabajos del francés Antoine Lavoisier y sus descubrimientos del oxígeno, la ley de conservación de masa y la refutación de la Teoría del flogisto como teoría de la combustión.
- 14. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 74 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo JacobusVan’t Hoff Propuso la hipótesis del carbono tetraédrico asimétrico, al mismo tiempo que A. Le Bel. Nace en Rotterdam (Holanda) Jacobus Van’t Hoff. Gobierno de Manuel Pardo. Gobierno de José Rufino Echenique. 1852 1874 1911 1901 Gobierno de Eduardo López de Romaña. Recibe el premio Nobel de Química por relacionar la termodinámica en las reacciones químicas y por sus estudios de las soluciones. Gobierno de Augusto B. Leguía y Salcedo. Fallece, en Berlín, Jacobus Henricus Van’t Hoff.
- 15. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 75 Educamos para la VIDA y también para la UNIVERSIDAD En los procesos restringidos se establece una relación matemática entre las variables de estado, en los diversos cambios que experimenta el cuerpo gaseoso, pero manteniendo constante su masa y otras de las variables de estado. 1.1. Ley de Boyle - Mariotte o Proceso Isotérmico 1. PROCESOS RESTRINGIDOS ‘‘Si la temperatura de una masa gaseosa es constante, la presión absoluta es inversamente proporcional a su volumen, y es constante’’. Estado 1 Estado 2 P1 ; V1 ; T1 P2 ; V2 ; T2 Donde: T1 = T2 = cte. Entonces: P1 V1 = P2 V2 1.2. Ley de Charles o Proceso Isobárico Estado 1 Estado 2 P1 ; V1 ; T1 P2 ; V2 ; T2 Donde: P1 = P2 = cte. Entonces: V2 T2 = V1 T1 ‘‘Si la presión de una masa gaseosa es constante, el volumen del gas es proporcional a su temperatura, y es constante’’. 1.3. Ley de Gay Lussac, Proceso Isométrico o Isocórico ‘‘Si el volumen de una masa gaseosa es constante, la presión es directamente proporcional a la temperatura, y es constante’’. 2. MEZCLA DE GASES Entre las propiedades de los gases se encuentra la de formar mezclas completamente homogéneas. 2.1. Fracción Molar (fm ) Indica el número de mol - g de uno de los componentes con respecto al número total de mol - g que tiene la mezcla. Estado 1 Estado 2 P1 ; V1 ; T1 P2 ; V2 ; T2 Donde: Entonces: V1 =V2 = cte. P2 T2 = P1 T1 Personaje del Tema Joseph Louis Gay-Lussac (Francia, 1778-París, 1850) Físicofrancés.SegraduóenlaÉcole Polytechnique Parisina en 1800. En 1802 observó que todos los gases se expanden una misma fracción de volumen para un mismo aumento en la temperatura, lo que reveló la existencia de un coeficiente de expansión térmica común que hizo posible la definición de una nueva escala de temperaturas, establecida con posterioridad por Lord Kelvin. En 1804 efectuó una ascensión en globo aerostático que le permitió corroborar que tanto el campo magnético terrestre como la composición química de la atmósfera permanecen constantes a partir de una determinada altura. En 1808, enunció la Ley de los volúmenes de combinación que lleva su nombre, según la cual los volúmenes de dos gases que reaccionan entre sí en idénticas condiciones de presión y temperatura guardan una relación sencilla. Estado Gaseoso II
- 16. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 76 Educamos para la VIDA y también para la UNIVERSIDAD nx :mol-g de uno de los componentes nt : total de mol-g de la mezcla nx nt = fmx Recuerda nt = n1 + n2 + n3 + ... +nx 1 = fm1 + fm2 + fm3 +... + fmx Pt : Presión de la mezcla P P Gas (i) : Presión parcial de un componente i Pt = P P Gas (1) + P P Gas (2) + P P Gas (3) + ... + P P Gas (x) 2.2. Ley de Dalton Dalton nos indica que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de cada componente. 2.3. Ley de Amagat Amagat nos indica que el volumen total de una mezcla de gases es igual a la suma de los volúmenes parciales de cada componente. Vt : Volumen de la mezcla VGas (i) : Volumen parcial de un componente i. PP Gas (x) = fm(x) Pt Vt = VPGas (1) + VGas (2) + VGas (3) + ... + VGas (x) VGas (x) = fm(x) Vt 2.4 Masa Molecular Aparente (MT ) Se sabe : =MT mt nt = m Gas (1) + m Gas (2) + ...+m Gas (x) nt =MT mt nt n1 M1 + n2 M2 + ... + nx Mx nt =MT fm1 M1 + fm2 M2 + ...+ fmx Mx=MT El deseo del hombre por volar provienedetiemposprehistóricos, ya que éste es vencido por la curiosidad de conocer nuevos lugares más allá de los que habita y descubre en el vuelo aéreo la posibilidad de ahorrarse tiempo y trabajo. Los primeros intentos que se realizaron con éxito datan del 21 de Noviembre de 1783, ese día el cielo de París vio asomar, majestuoso, un gigantesco globo decorado en oro y azul. A bordo iban Pilatre de Rozier, un físico de 29 años y el comandante Francois Laurent, Marqués de Arlandes y oficial de infantería. El globo, que era una enorme estructura de papel y tela, estaba inflado con aire caliente, generado por el fuego ubicado bajo la abertura inferior, el cual a su vez era alimentado por los tripulantes con paja seca. Más tarde el Montgolfier, como se llamaba el globo (en honor a los hermanos Joseph y Etienne Montgolfier, que fueron los primeros en lanzar un globo sin tripulantes y aplicar el recién descubierto gas de hidrógeno para llenar el interior del mismo), tocó tierra en las afueras de París, con sus ocupantes sanos y salvos.
- 17. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 77 Educamos para la VIDA y también para la UNIVERSIDAD Ejemplo: Existe un grupo de gases inertes denominados comercialmente f r e o n e s . S o n d e r i v a d o s polihalogenados del metano y del etano que contienen flúor, cloro o bromo; y se usan como impulsadores de aerosoles y como refrigerantes. Los aerosoles son pequeñísimas partículas de productos químicos, aceite y partículas de polvo; siendo su tamaño de una a diez micras y escapando a la acción de la gravedad,manteniéndosesiempre en suspensión, sin posarse nunca. Los freones de mayor utilización son el triclorofluorometano CCl3 F y el diclorodifluorometano CCl2 F2 , conocidos industrial- mente como Freón - 11 y Freón - 12, respectivamente. Estos gases ascienden hasta alturas de 20 kilómetros o más, en donde la radiación ultravioleta los disocia, y libera el cloro (Cl). El cloro y el ozono tienen diversas reacciones convirtiéndose éste último en oxígeno, lo cual origina una amenaza para la capa de ozono. Halla la masa molecular aparente de una mezcla de hidrógeno y cloro gaseosos, sabiendo que la fracción molar de hidrógeno es 0,2. (M (H) = 1 ; M (Cl) = 35,5) fmH2 + fmCl2 = 1 0,2 + fmCl2 = 1 fmCl2 = 0,8 Resolución: M(H2) = 2(1) = 2 Ahora: M(Cl2) = 2(35,5) = 71 Entonces: → MT = fmH 2 MH 2 + fmCl 2 MCl 2 MT = 0,2(2) + 0,8(71) MT = 57,2g/mol 1) Cierto gas está sometido a 5 atm de presión y 27°C; luego aumenta su volumen al doble por un incremento de 50°C de temperatura. Halla la variación de la presión. P1 = 5 atm P2 = ? V1 = V V2 = 2V T1 = 27°C + 273 = 300 K T2 = 27°C + 50°C = 77°C → 77+273 = 350 K Luego: 5 x 350 2 x 300 = P2 P2 x 2V 350 = 5 x V 300 P2 = 2, 916 atm Entonces: Luego, hallando la variación de la presión: P1 - P2 = 5 - 2,916 P1 - P2 = 2,084 atm Para resolver este problema se utiliza : = P2 V2 T2 P1 V1 T1 Resolución: 2) La presión de un gas ideal disminuye en10%, mientras que su volumen aumenta en 5%. ¿Cuál es la variación de la temperatura? Resolución: Para la resolución de este problema utilizamos : = P2 V2 T2 P1 V1 T1 Entonces: P2 V2 T2 P1 V1 T1 = Sea: P1 = 100 P, entonces P2 =90 P (ya que disminuye en 10%) V1 = 100 V, entonces V2 = 105 V (ya que aumente en 5%) T1 = T1 T2 = T2
- 18. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 78 Educamos para la VIDA y también para la UNIVERSIDAD Supongamos que T1 = 100 T, entonces: (100P) (100 V) T1 = (90P) (105 V) T2 Luego la variación será: T2 = (T1 - T2 ) T1 x 100% → 100T - 94,518 T 100T 5,482 T 100 T x 100%= = 5,482 % (100P) (100 V) (90 P) (105 V) = T1 T2 = 1,058→ T1 T2 = 1,058 →T2 = 100 T T2 100 T 1,058 T2 = 94, 518 T→ 3) A cierto Gas en un balón encerrado se le aumenta la temperatura en 10°C, entonces su presión aumenta en 10%. Halla la temperatura inicial en kelvin. Ahora: Observamos que esto ocurre en un balón cerrado, o sea a un mismo volumen. P1 = 100 P P2 = 110 P (ya que aumenta en 10%) T1 = T °C T1 = (T + 273) K (convirtiendo a kelvin) T2 = (T + 10)°C T2 = (T + 10 + 273) K Luego: Al utilizar : Luego en la ecuación (*) reemplazamos: { → 10 (T + 283) = 11 (T + 273) 10 T + 2830 = 11 T + 3003 10 T - 11T = 3003 - 2830 - T = 173 T = -173 Realizamos las operaciones para hallar la variable ‘‘T’’. Sabemos que: T1 = T° C → T1 = - 173° C Convertimos a kelvin: → (T + 273) → (-173 + 273) → 100 K Observamos que este fenómeno ocurre a bajas temperaturas por lo cual nuestra temperatura es negativa en grados celsius. , entonces V1 = V2 = P1 V1 T1 P2 V2 T2 Resolución: = P1 V1 T1 P2 V2 T2 P1 T1 → ... (*)= P2 T2 100 P (T + 273) 110 P (T + 273) P1 T1 = P2 T2 → = 4) Se tiene una mezcla de gases (A, B, y C) con 60 g de A , 80 g de B y 5 moles de C con PMA = 30 g/ mol y PMB = 16 g/mol. Halla la fracción molar de cada gas. Nosestánpidendofracciónmolar(fmx ), entonces, como sabemos que tendremos que hallar el número de moles totales y el de cada gas. Para A : WA PMA nA = =WA = 60 g PMA = 30 g/mol Resolución: nx nt fmx = = 2 moles 60 30 Para B : WB = 80 g PMB = 16 g/mol WB PMB nB = = = 5 moles 80 16 Ahora hallando la fracción molar de cada gas. Luego: nT = nA + nB + nC nT = 2 + 5 +5 nT = 12 fmA = = 2 12 1 6 fmB = = 5 12 5 12 fmC = 5 12
- 19. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 79 Educamos para la VIDA y también para la UNIVERSIDAD 9) Cuando el proceso es isobárico, la variable que permanece constante es: a) Masa b) Presión c) Volumen d) Temperatura e) Velocidad Sabemos que: PPi = fmi PT Entonces hallaremos fmi ya que PT = 12 atm. 5) En un balón cerrado se tiene una mezcla de gases (O2 , Ne y H2 ). Si el recipiente contiene 64 g de O2 , 10 g de H2 y 20 g de Ne, calcula la presiónparcialdelNesielbalónestá sometido a una presión de 12 atm. P.A (O = 16, H = 1, Ne = 20) Resolución: hallando fmi → n T = nO 2 +n H 2 + n Ne n T = 2 + 5 + 1 n T = 8 Xi = ni nT Luego fmNe = Entonces: WO 2 PMO 2 nO2 = = = 2 64 2(16) → WH 2 PMH 2 nH2 = = = 5 10 2(1) → WNe PMNe nNe = = = 1 20 20 1 8 PP(Ne) = (12 atm) → PP(Ne) = atm 1 8 3 2 Nivel I 1) En un proceso isotérmico, cuando la presión se triplica el volumen disminuye en 12 L. Halla el volumen inicial. a) 12 L b) 16 L c) 18 L d) 20 L e) 25 L 2) En un proceso isócoro cuando la presión se duplica, la temperatura aumenta en 600 K. Halla la temperatura en °C. a) 27 °C b) 127 °C c) 227 °C d) 327°C e) 427 °C 3) En un proceso isobárico cuando el volumen aumenta en 25%, la temperatura aumentar en 300 K. Halla la temperatura inicial en °C. a) 900 b) 927 c) 1027 d) 1017 e) 1007 4) Una masa de O2 ocupa 30 ml a 27° C. Halla el volumen en cm3 a 127° C si se cumple un proceso isobárico. a) 40 b) 30 c) 20 d) 10 e) 80 5) En un proceso isotérmico cuando la presión aumenta 25%, ¿qué sucede con el volumen? a) Aumenta 20% b) Disminuye 20% c) Amenta 80% d) Disminuye 80% e) No varía 6) Relaciona correctamente: I) Isócoro : Charles II) Isobárico : Gay Lussac III) Isotérmico : Boyle Mariotte a) I y II b) II y III c) I y III d) Sólo III e) SóloII 7) En un proceso isotérmico cuando la presión aumenta 20%, el volumen disminuye 6 L. Halla el volumen inicial. a) 6 L b) 12 L c) 24 L d) 48 L e) 36 L 8) Cuando un proceso es isotérmico, la variable que permanece constante es: a) Tiempo b) Presión c) Volumen d) Temperatura e) Densidad 10) Cuando un proceso es isocórico, la variable que permanece constante es: a) Masa b) Volumen c) Presión d) Temperatura e) Densidad
- 20. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 80 Educamos para la VIDA y también para la UNIVERSIDAD Nivel II11) Un gas ideal ocupa un volumen de 4 litros a 3 atm y 127° C. Si se calienta en 27° C a 6 atm, ¿qué volumen ocupa? a) 2,135 L b) 1,125 L c) 2,205 L d) 1,305 L e) 0,125 L 12) Si la temperatura absoluta de un gas aumenta en 50% de su valor inicial, mientras que su presión disminuye en un 50% de su valor inicial, ¿qué sucede con el volumen? a) Aumenta en 80% b) Disminuye en 300% c) No varía d) Aumenta en 200% e) Disminuye en 50% 13) La temperatura de un gas se eleva de 27° C a 87° C. ¿Cuál debe ser la variación de presión expresado en porcentaje para que no cambie el volumen? a) 10 % b) 20 % c) 30 % d) 40 % e) 100 % 14) Un gas ideal ocupa un tanque cerrado a 4,5 atm a cierta temperatura. Si escapa 6g de gas y la presión disminuye a 3 atm, halla la masa inicial si además la temperatura no varía. a) 16 g b) 15 g c) 18 g d) 20 g e) 24 g 15) Halla el número de moléculas del gas oxígeno (O2 ) cuando esté ocupando un volumen de 60 litros y se encuentre a la presión de 8,2 atm y a una temperatura de 27°C. a) 2 No b) 0, 2 No c) 20 No d) 2000 No e) 0,02 No 16) Halla la masa molecular de una mezcla de hidrógeno y oxígeno gaseosos sabiendo que la fracción molar del hidrógeno es 0,2. (P.A. (H) = 1 ; P.A. (O) = 16) a) 26 b) 30 c) 57,2 d) 28,2 e) N.A. 17) En un recipiente de 900 L se mezcla oxígeno y metano de tal manera que la masa de oxígeno es el doble de la masa del metano. Halla el volumen parcial del metano (CH4 ). a) 45 L b) 450 L c) 900 L d) 90 L e) 180 L 18) Se tiene 240 ml de gas metano, luego de un proceso isotérmico la presión se duplica. ¿Cuál es el nuevo volumen? a) 240 ml b) 120 ml c) 140 ml d) 200 ml e) 220 ml 19) 35 litros de cierto gas que se hallaba a -13°C, isobáricamente su volumen se expande hasta ocupar 80 litros. ¿Cuál es la temperatura final del gas en la escala centígrada? a) 594, 28 b) 321, 28 c) 260 d) 340 e) 200 20) La presión que se ejerce sobre 40 litros de un gas aumenta desde 10 atmósferas a 20 atmósferas. Calcula el volumen final si la temperatura permanece constante (proceso isotérmico). a) 30 L b) 15 L c) 20 L d) 25 L e) 12 L 21) Si la densidad de un gas es 2 g/L a condiciones normales, halla su peso molecular. a) 100 g/mol d) 44,8 g/mol b) 200 g/mol e) 11,2 g/mol c) 22,4 g/mol 22) Se tiene 2L de gas a 27°C. ¿A cuánto habrá que elevar la temperatura para que la presión aumente en un 20% si el volumen es constante? a) 87°C b) 25°C c) 27°C d) 37°C e) 127°C 23) En cierto proceso gaseoso la presión se mantiene constante. Si la temperatura aumenta en 100%, ¿en qué porcentaje varía su densidad? a) Aumenta en 100% b) Disminuye en 100% c) No varía d) Aumenta en 50% e) Disminuye en 50% 24) Cierto gas ideal se somete a un proceso isotérmico. Si la relación de su presión inicial y final (P1 /P2 ) es 0,25, ¿cuánto valdría la relación de sus densidades (D1 /D2 )? a) 1/2 b) 2/3 c) 1/4 d) 1/5 e) 5/1
- 21. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 81 Educamos para la VIDA y también para la UNIVERSIDAD 25) Si la presión absoluta de un gas aumenta en 20% y la temperatura disminuye en 40% (ambos con respecto a su valor inicial), ¿en qué porcentaje varía su volumen? a) Aumenta en 20% b) Disminuye en 20% c) Aumenta en 50% d) Disminuye en 50% e) No varía Nivel III 26) En un recipiente de 12,5 litros se introducen pesos iguales de N2 y CH4 . Calcula el peso total introducido si a 27°C la presión en el recipiente es de 6 atm. a) 54,5 g b) 50,4 g c) 51 g d) 52,4 g e) 62 g 27) En un cilindro cerrado se tienen mezclados “x” gases de manera que se cumple: P1 + P2 + P3 + ... +Px = 4atm fm1 + fm2 + fm3 + ... + fm(x-1) = 0,75 Determina el número de moles del gas “x” si la capacidad del cilindro es de 410L y la temperatura 172°C. a) 12,5 moles b) 10,25 moles c) 8,40 moles d) 7,32 moles e) 2,5 moles 28) ¿Qué presión ejerce una mezcla formada por 48g de oxígeno gaseoso con 8g de helio, contenidos en un recipiente de 70 L a 225°C? P.A.(He = 4, O = 16) a) 2,9 atm b) 2,6 atm c) 2,04 atm d) 2,7 atm e) 2,8 atm 29) El siguiente cilindro contiene gas helio. Si la presión se incrementa de 1 a 1,5 atm y la temperatura de 27°C a 127°C, ¿cuántos centímetros se desplazó el émbolo? a) 4 cm b) 5 cm c) 6 cm d) 10 cm e) 15 cm V P TÉmbolo 90cm 30) Indica la ecuación universal de los gases ideales. a) PV = RnM b) PV = RTn c) = d) = e) = P1 V1 T1 P2 V2 T2 M1 M2 V1 V2 P1 V1 T1 P2 V2 T2 31) Indicalosprincipalescomponentes del aire. a) N2 y O2 b) N2 y H2 c) N2 y H2 O d) H2 y O2 e) Cl2 y N2 32) Indica el volumen de dos moles de un gas ideal a condiciones normales. a) 22,4 L b) 224 L c) 10 L d) 44,8 L e) 11,2 L 33) Indica el volumen de 10 moles de un gas ideal a condiciones normales. a) 224 L b) 44,8 L c) 10 L d) 5 L e) 2,4 L 34) Indica la presión de un gas ideal que ocupa 10 L a 27°C, n = 1/3. a) 5 atm b) 0,82 atm c) 4 atm d) 4,1 atm e) 3,9 atm 35) No es unidad de presión. a) bar b) atm c) K d) mmHg e) torr 36) ¿Qué volumen ocupará 66g de CO2 a 0°C y 760 mmHg? a) 11,2 L b) 22,4 L c) 33,6 L d) 44,8 L e) 76,2 L 37) Cierto gas se encuentra en un cilindindro, tal como se muestra en el gráfico. Si el émbolo se desplaza conforme se señala. ¿cuál es la alternativa incorrecta? a) La presión aumenta. b) La temparatura se incrementa. c) Aumenta la energía cinética del gas. d) Como se comprime, el gas disminuye el número de mo- léculas. e) Se incrementa la fuerza intra- molecular. V P T gas
- 22. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 82 Educamos para la VIDA y también para la UNIVERSIDAD 38) ¿Cuál de los siguientes gases tiene la mayor densidad a 50°C y 720 torr? a) Amoniaco b) Oxígeno c) Monóxido de carbono d) Anhídrico carbonoso e) N.A. 39) En cierto proceso industrial se liberan 32,8L de CO2 a 127°C y 2,5 atm por cada hora. ¿Cuántas moléculas de CO2 en 10 horas contribuirán al efecto invernadero? a) 25 x 1023 b) 2,4 x 1024 c) 1,5 x 1024 d) 2,5 x 1025 d) 1,5 x 1025 40) Se tiene una muestra de 20g de yeso (CaSO4 .2H2 O). Determina el número de moleculas que se evaporarían si la eficiencia del proceso es de 70%. a) 0,98 x 1023 b) 0,98 x 1022 c) 0,98 x 1021 d) 0,98 x 1020 d) 0,98 x 1019 41) ¿Cuántas moléculas de agua existirán en 448L de carbonato de sodio pentahidratado vaporizado a 0°C y 1 atm? a) 6,023 x 1022 b) 6,023 x 1023 c) 6,023 x 1024 d) 6,023 x 1025 e) 1,2046 x 1026 42) ¿Cuántosátomosdeoxígenoexisten en 800g de BORAX (B4 O7 Na . 10 H2 O) aproximadamente? a) 2,28 x 1025 b) 2,28 x 1024 c) 2,28 x 1023 d) 2,28 x 1022 e) 2,28 x 1021 43) ¿Qué volumen ocupan 12,046 x 1023 moléculas de gas hilarante N2 O a 1 atm y 273K? a) 5,6L b) 44,8L c) 20L d) 22,8L e) 22,4L 44) Se trae al laboratorio AFUL, 600g de un gas marciano cuya masa molecular promedio es 120 g/mol. Si ocupa 164L a 5 atm, ¿a qué temperatura se encuentra almacenado? a) 1 000K b) 500K c) 2 000K d) 1 500K e) 2 500K 45) ¿A cuántos °C se encuentra 0,1 mol de N2 en un recipiente de 627 ml a 4,1 atm? a) 42,5°C b) 40,5°C c) 39,6°C d) 66,5°C e) 50,5°C 46) ¿Qué volumen ocupa 128 gramos de gas O2 a 127°C y 1 atmósfera? a) 22,4 L b) 65,6 L c) 44,8 L d) 131,2 L e) N.A. 47) Determina la densidad del metano (CH4 ) a una presión de 780mmHg y a una temperatura de 127°C. a) 0,5 g/L b) 0,3 g/L c) 1 g/L d) 1,5 g/L e) 2 g/L
- 23. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 83 Educamos para la VIDA y también para la UNIVERSIDAD Nivel I 1) ¿Cuál no es una variable fundamental del estado gaseoso? a) Volumen b) Presión c) Tiempo d) Temperatura e) a y b 2) Un gas se encuentra a: P=0,082 atm T = 127°C V=400L Halla los moles que existe. a) 1 mol b) 2 mol c) 3 mol d) 4 mol e) c y d 3) El metano (CH4 ) se encuentra a una presión de 0,82 atm y temperatura 127° C ocupando un volumen de 40 L. Halla los moles que existe. a) 1 mol b) 2 mol c) 3 mol d) 4 mol e) 5 mol 4) Halla el volumen de un mol de un gas a 0° C y a la presión de 760 mmHg. a) 22,4 L b) 2,24 L c) 224 L d) 2240 L e) 222 L 5) Halla el peso molecular de un gas que presenta: Peso = 48g T = 127°C P = 12 atm V = 8,2 L a) 16 b) 32 c) 64 d) 4 e) 37 6) Un mol de un gas se encuentra a T = 127° C y ocupa un volumen de 6240 L. Halla la presión que soporta en mmHg. a) 40 b) 20 c) 60 d) 80 e) 100 7) Halla los moles que existe de un gas si este se encuentra a: T = 127° C, P = 12 atm y ocupa un volumen de 8,2 litros. a) 3 mol b) 2 mol c) 15 mol d) 5 mol e) 6 mol 9) Halla el volumen en litros de 4 moles de un gas a: P = 124,8 mmHg; T = 27° C. a) 600 L b) 300 L c) 1200 L d) 400 L e) 225 L 10) Halla la masa de un gas que presenta: P = 64 atm ; T = 27° C; V = 8,2 L ; M = 16 a) 16 g b) 32 g c) 64 g d) 128 g e) 341,3 g 11) Un gas se encuentra a la temperatura de 105 K y presenta una densidad de 0,01 g/L a la presión de una atmósfera. Halla su peso molecular existente. a) 82 b) 0,82 c) 8,2 d) 128 e) 4,7 12) Un mol de gas oxígeno (O2 ) se encuentra a: P = 0,082 atm T = 127° C; V = 400 L Halla el número de moles que existe: a) 3 mol b) 2 mol c) 15 mol d) 5 mol e) 6 mol 13) Si 5,75g de un gas ocupa un volumen de 3,4 L a una temperatura de 50° C y una presión de 0,94 atm, ¿cuál es su peso molecular? a) 187 b) 47,7 c) 27,8 d) 54,3 e) 31,4 14) ¿Cuál es la densidad de un compuesto gaseoso, cuyo peso molecular es 34 g/mol a 67° C y 5 atm? a) 5 g/L b) 6 g/L c) 7 g/L d) 8 g/L e) 9 g/L 15) Un matraz de 250 ml (vacío) tiene una masa de 300 g. Si se llena con gas metano CH4 a condiciones normales, ¿cuál es la masa? a) 300,178 g d) 300,456 g b) 300,008 g e) 301,095 g c) 300,018 g 8) Halla la densidad de un gas que presenta: P = 16,4 atm; T = 27° C; M = 6. a) 2 b) 4 c) 8 d) 16 e) 5 Ejercicios de Reforzamiento
- 24. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 84 Educamos para la VIDA y también para la UNIVERSIDAD 16) Halla la densidad del gas metano CH4 a 227° C y 624 mmHg. a) 0,8 g/L d) 0,48 g/L b) 0,16 g/L e) 0,96 g/L c) 0,32 g/L Nivel II 17) En un recipiente de 250 ml se tiene 4,8 g de oxígeno gaseoso a 27° C. ¿Cuál es la presión en atmósferas que ejerce el gas? a) 14,76 atm d) 3,69 atm b) 1,476 atm e) 1,23 atm c) 7,38 atm 18) Un matraz de 1L se llena con dióxido de carbono en condiciones normales y se cierra. ¿Cuántos gramos de gas hay encerrados en el matraz? a) 1,96 g b) 3,93 g c) 7,85 g d) 0,79 g e) 0,82 g 19) El número de moléculas de O2 contenidas en un recipiente de 8,2 L a 27° C y 3 atm es: a) 6,0 x 1020 d) 1,2 x 1024 b) 1,2 x 1023 e) 2,0 x 1022 c) 6,0 x 1023 20) La densidad en g/L del CO2 medidos a 27° C y 0,82 atm es: a) 2,0 b) 1,47 c) 1,58 d) 1,26 e) 3,12 21) En un mol de gas a STP se tiene 22,4; esto indica: a) Ecuación general de gases. b) Ecuación de gases ideales. c) Volumen molar. d) Número de Avogadro. e) Presiones parciales de gases. 22) Calcula la densidad del SH2 en g/L a 27° C y 2atm. a) 27,6 b) 2,76 c) 0,276 d) 2,1 e) 2,17 23) Calcula el volumen, en litros, de 0,006 moles de un gas a 31° C y 0,870 atm. a) 0,34 b) 0,51 c) 0,68 d) 0,17 e) 0,85 24) La presión en el interior de un globo de 2,23 L es de 1,10 atm. Si el volumen del globo aumenta a 7,05 L, ¿cuál es la presión final en el globo si no hay cambio en la temperatura? a) 0,25 atm d) 0,55 atm b) 0,35 atm e) 0,65 atm c) 0,45 atm 25) Se tiene una barra de aluminio de 30 x 10 x 3 cm; en STP y con una densidad de 2,7 g/cm3 . ¿Cuántas moléculas presenta? (P.A. = 27) a) 27 No b) 30 No c) 24 No d) 90 No e) 10 No 26) ¿Cuál es la densidad del gas acetileno (C2 H2 ) a 300 K y 8,2 atm? a) 5 g/L b) 4 g/L c) 8 g/L d) 6 g/L e) 2 g/L 27) Halla la masa molar de un gas que ocupa un volumen de 300 ml a una temperatura de 27° C. con una presión de 4,1 atm y masa de 2,1g. a) 42 b) 46 c) 48 d) 52 e) 54 28) Se sabe que 0,563 g de un vapor ocupa un volumen de 265 ml a temperatura de 373 K y presión de 725 mmHg. Determina su masa molecular. a) 82,2 b) 48,2 c) 68,2 d) 56,5 e) 66,6 29) Ungasidealocupaunvolumende 8La6atmy27°C.¿Quévolumen se tendrá a 5 atm y 127° C? a) 12,5 L b) 12,8 L c) 16,1 L d) 20,4 L e) 22,4 L 30) El volumen de un gas disminuye en 20% y su temperatura aumenta en 60%. Luego la presión aumenta en: a) 80% b) 70% c) 50% d) 60% e) 100% 31) La presión de un gas aumenta 70% y la temperatura disminuye 40%. Determina la variación del volumen. a) Aumenta 35,2% b) Disminuye 35,2% c) Aumenta 44,6% d) Aumenta 64,8% e) Disminuye 64,8% Nivel III 32) Un gas cumple la Ley de Gay -Lussac, su presión se incrementa de 2 a 4 atm, cuando su temperatura se eleva en 200° C. Halla su temperatura final. a) 100 K b) 300 K c) 400 K d) 500 K e) 200 K 33) Se calienta cierta masa de gas de 27° C a 117° C sin que varíe su presión. ¿En qué porcentaje aumenta su volumen? a) 60% b) 90% c) 70% d) 30% e) 20%
- 25. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 85 Educamos para la VIDA y también para la UNIVERSIDAD 34) Un gas está a una temperatura ‘‘2T’’, su presión es ‘‘P’’ y su volumen ‘‘V’’. Si varía su temperatura a ‘‘4 T’’ y su volumen a ‘‘2 V’’, señala su nueva presión. a) 0,05P b) 2,5P c) 2P d) P e) 0,5P 35) ¿Qué volumen en litros de oxígeno a C.N. es necesario en un recipiente de 28 litros que inicialmente contiene oxígeno a C.N. para que alcance una presión de 12,3 atmósferas a 147° C? a) 96 L b) 144 L c) 184 L d) 98 L e) 196 L 36) En un proceso isobárico, 2 g de oxígeno ocupan un volumen de 280 ml a 127° C. ¿Cuál será el volumen, en ml, cuando la temperatura desciende hasta 27° C? a) 210 ml b) 180 ml c) 160 ml d) 105 ml e) 320 ml 37) En un proceso isotérmico, si se aumenta la presión: a) Aumenta la temperatura. b) Aumenta el volumen. c) Disminuye la temperatura. d) Disminuye el volumen. e) a y b 38) Sia5litrosdeungasacondiciones normales se le comprime hasta una presión de 4 atmósferas a temperatura constante, ¿cuál es su volumen final? a) 3 L b) 0,8 L c) 2,2 L d) 1,25 L e) 4,6 L 39) La densidad de un gas a determinadas condiciones es 0,1 g/L. Si la presión aumenta en un 50% y disminuye su temperatura en 30%, ¿cuál será la nueva densidad del gas? a) 0,6 g/L b) 0,1 g/L c) 0,2 g/L d) 3,2 g/L e) 4,1 g/L 40) La presión de un gas se incrementa de ‘‘n’’ a ‘‘m’’ atmósferas y la temperatura varía de ‘‘p’’ a ‘‘q’’ grados kelvin. ¿Cuál es el volumen final si inicialmente se tenía ‘‘v’’ litros? a) nvm/pq d) nvq/pm b) pmn/qv e) pqm/nv c) nvq(273)/pm 41) Jacques Charles manifestó el proceso isobárico, el cual indica que .... debe permanecer constante. a) la presión b) la temperatura c) el volumen d) la densidad e) el tiempo 42) ¿Qué expresión es incorrecta? a) En un proceso isotérmico se m a n t i e n e constante la temperatura. b) En un proceso isobárico se mantiene constante la presión. c) En un proceso isobárico se mantiene constante el volumen. d) En un proceso isocórico s e mantiene constante el volumen. e) En un proceso isobárico se mantiene constante la masa. 43) En todo proceso restringido, la variable que permanece constante, necesariamente, es: a) Presión d) La masa b) Temperatura e) Volumen c) Densidad 44) Un gas ocupa un volumen de 1 L a una temperatura A K y a una presión de B atm. Si se disminuye la presión del gas a B/2 atm y se eleva la temperatura a 2A K, ¿qué volumen ocupará dicho gas? a) 2 L b) 4 L c) 6 L d) 8 L e) 10 L 45) Si el volumen de un gas aumenta en 150% y su temperatura se duplica, entonces: a) No cambia la presión. b) No sucede nada. c) La presión final es el 80% de la inicial. d) No cambia la temperatura. e) La presión final es el 75% de la inicial. 46) En un proceso isotérmico una cierta masa gaseosa ocupa 120 L a 200 atm y 400 K. ¿Cuál sería el nuevo volumen si la nueva presión disminuye en un 25%? a) 80 L b) 120 L c) 160 L d) 200 L e) 140 L 47) ¿Qué masa representa 650 ml de nitrógeno gaseoso a 750 mmHg y 27° C? a) 1,58 g b) 0,73 g c) 2,52 g d) 3,45 g e) 10,42 g 48) Si aumentamos la temperatura y redujéramos la presión de un gas, entonces: a) El volumen disminuye . b) El volumen aumenta. c) Elvolumen permanece constante. d) No se puede determinar porque se desconoce los incrementos y descensos. e) c y d
- 26. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 86 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo SvanteAugust Arrhenius Recibe la primera medalla Willard Gibbs. Nace en Upsala (Suecia), August Arrhenius. Inicio del Gobierno de Óscar R. Benavides. 1859 1903 1927 Oncenio de Leguía. 1884 1889 1911 1914 Gobierno de Augusto B. Leguía. Fallece, August Arrhenius. Observó que la velocidad de las reacciones químicas aumenta notablemente con la temperatura. RecibeelpremioNobeldeQuímicaenreconocimiento a sus estudios sobre la Teoría de la disociación electrolítica. Desarrolló la Teoría del ión. Recibe la medalla Faraday. Gobierno de Manuel Cándamo. Gobierno de Ramón Castilla. Gobierno de Miguel Iglesias. Gobierno de Andrés Avelino Cáceres.
- 27. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 87 Educamos para la VIDA y también para la UNIVERSIDAD Personaje del Tema Es la parte de la química que se encarga de estudiar las relaciones cuantitativas que existe entre las diferentes sustancias que participan en una reacción química. Antoine Laurent Lavoisier (1743 - 1794) Químico francés y padre de la química moderna, Antoine L a u r e n t Lavoisier fue un experimentador brillante y genio de muchas facetas, activo tanto en ciencias como en asuntos públicos. Desarrolló una nueva teoría de la combustión que llevó a terminar con la doctrina del flogisto, que había dominado el curso de la química por más de un siglo. Sus estudios fundamentales sobre oxidación demostraron el papel del oxígeno en los procesos químicos y mostraron cuantita- tivamente la similitud entre oxidación y respiración. Formuló el principio de la conservación de la masa en las reacciones químicas. Clasificó la distinción entre elementos y compuestos y fue clave en el diseño de un sistemamodernodenomenclatura química. Lavoisier fue uno de los primeros científicos en introducir procedimientos cuantitativos en las investigaciones químicas. LEYES PONDERALES “La suma de las masas de los reactantes es igual a la suma de las masas de los productos’’. I. Ley de la Conservación de la Materia (Lavoisier) Ejemplo: Zn+ H2 SO4 → ZnSO4 + H2 Zn+ H2 SO4 → ZnSO4 + H2 65g + 98g = 161g + 2g 163g = 163g ProductosReactantes “Cuando dos o más sustancias se combinan para formar un determinado producto, lo harán en proporción ponderal fija y definida, entonces el exceso de una de ellas quedará sin reaccionar”. II. Ley de las Proporciones Definidas (Proust) Ejemplo: N2 + 3 H2 → 2 NH3 ↓ ↓ ↓ 28 g 6 g 34 g La relación entre el peso del hidrógeno y nitrógeno es: Esta relación (3/14) es invariable según la ley de Proust. = 6 g 28 g 3 14 “Si dos elementos forman varios compuestos, permaneciendo el peso de uno de ellos constante, el peso del otro elemento varía, siendo siempre múltiplo del peso mínimo que participó”. III. Ley de las Proporciones Múltiples (Dalton) Estequiometría I
- 28. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 88 Educamos para la VIDA y también para la UNIVERSIDAD Ejemplo: N2 O ; N2 O3 ; N2 O4 ; N2 O5 ↓ ↓ ↓ ↓ 28g 28g 28g 28g 16g 3 x 16g 4 x 16g 5 x 16g “Los pesos de dos elementos o múltiplos de éstos; que reaccionan con un mismo peso de un tercero, son los mismos con que reaccionan entre sí”. IV. Ley de las Proporciones Recíprocas (Wenzel - Richter) Ejemplo: 2 Na + H2 → 2 NaH 2 Na + Cl2 → 2 NaCl Cl2 + H2 → 2 HCl 46 g 71 g 46 g 71 g ó 23 g 35,5 g LEYES VOLUMÉTRICAS Estas leyes relacionan el volumen de las sustancias que participan en una reacción química, estas relaciones sólo se limitarán para las sustancias gaseosas’. A) La relación de combinación entre los volúmenes de las sustancias que reaccionan es constante, definida e igual a la relación que hay entre el número de mol - g. 2 SO2(g) + 1O2(g) → 2 SO3(g) 2 V(SO2) 1 V(O2) 2 V(SO3) V es el volumen que puede ser inclusive el volumen molar (Vm ) y que a C.N. es 22,4 L/mol - g. No olvidar que estas reacciones se realizan a igual P y T, y especialmente para gases. B) De igual forma se tiene que el volumen total de los gases reaccionantes es mayor o igual al volumen total de los gases resultantes. 1 N2 + 3 H2 → 2 NH3 ↓ ↓ ↓ 1V 3V > 2V En gases 2 SO2(g) + 1 O2(g) → 2 SO3(g) 2L (SO2 ) 1L (O2 ) 2L (SO3 ) 2pie3 (SO2 ) 1pie3 (O2 ) 2pie3 (SO3 ) 2(22,4L) 1(22,4L) 2(22,4L) Ejemplo: a C.N. = nA a nB b nC c = WA a MA WB b MB WC c MC WD d MD = = nD d = = Para ejemplificar una reacción química y su estequiometría que sueles disfrutar, basta analizar el caso del queque. Para hacer uno se necesita, por lo general, mantequilla, leche, harina, huevo y azúcar. Todos ellos son los reactantes cuyas cantidades estequiométricas deben ser adecuadas para que salga un buen queque. También se requiere la energía en forma de calor para acelerar la reacción que es proporcionada por el horno eléctrico. Luego lo que obtenemos es un delicioso queque, que sería el producto. Es algo completamente nuevo,elresultadoesunareacción química que ha cumplido con las leyes estequiométricas. VREACCIONANTES ≥ VPRODUCTOS = 24 1 n 5 Regla Práctica: a A + b B → c C + d D ó Ejemplo: ¿Cuántos mol - g de oxígeno se requiere para la combustión de 24 mol - g de gas propano (C3 H8 )? 1 C3 H8 + 5 O2 → 3 CO2 + 4 H2 O → n = 120 mol - g O2
- 29. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 89 Educamos para la VIDA y también para la UNIVERSIDAD 1. Halla la masa de NaOH que se forma con 46 g de Na y 40 g de H2 O. Halla el reactivo limitante en: Na + H2 O → NaOH + H2 P.A. (Na = 23, O = 16, H = 1) Resolución: Para hallar la masa de NaOH formado tendremos que relacionarlo con las moles, en la ecuación química correctamente balanceada. 2 Na + 2 H2 O → 2 NaOH + 1 H2 2 mol 2 mol 2 mol 1 mol 2(23)g 2(18)g 2(40)g 1(2)g PMH2O = 2 (1) + 16 = 18g PMNaOH = 1 (23) + 1(16) + 1 (1) = 40g Notamos que: 2 Na + 2 H2 O → 2 NaOH + H2 46g 36g 80g Dato → 46g 40g x 46 g de Na reacciona con 36 g de H2 O y producen 80 g de NaOH. Luego no reaccionan 4 g de H2 O que es el reactivo en exceso. WNaOH = 80 g Reactivo limitante = Na La ecuación química se balancea por el Método del Tanteo. Luego notamos que el reactivo limitante es el Na y el reactivo en exceso es el H2 O. Para poder resolver este problema balanceamos la ecuación, entonces: 2KClO3 → 2KCl + 3O2 2 mol 3 mol 2 (122,5) g 3 mol PMKClO3 = 122,5 245 g 3 mol 2KClO3 → 2KCl + 3O2 245g 3 mol Dato: 490g x mol 2. Indica cuántas moles de oxígeno se forman con 490 g de KClO3 en la siguiente reacción: KClO3 → KCl + O2 P.A. (Cl = 35,5; K = 39; O = 16) Resolución: Hacemos la relación de moles. Estoquieredecirque245gde KClO3 ,pordescomposición, forma 3 moles de O2 . Ahora por regla de tres simple: (245)x = 3 x (490) x = x = 3 x 2 x = 6 moles de oxígeno 3 x 490 245 3. En la descomposición del carbonato de calcio (CaCO3 ) se produce CaO y CO2 . Si se forman 44 g de dióxido de carbono, ¿cuál es la cantidad utilizada de CaCO3 ? P.A. (C = 12 ; Ca = 40 ; O = 16) Resolución: La reacción es: CaCO3 → CaO + CO2 Notamos que esta balanceada, entonces: CaCO3 → CaO + CO2 1 mol 1 mol 100 g 44 g Dato: x 44 g PMCaCO3 = 100 PMCO2 = 44 Notamos que ‘‘x’’ será 100g. x = 100 g de CaCO3
- 30. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 90 Educamos para la VIDA y también para la UNIVERSIDAD Nivel I 1) ¿Cuántos gramos de oxígeno se produce al someter a calentamiento 40 g de clorato de potasio? 2KClO3 → 2KCl + 3O2 a) 96 g b) 15,7 g c) 245 g d) 40 g e) 32,5 g 4. En la siguiente reacción: Zn + HCl → ZnCl2 + H2 3,612 x 1024 moléculas de HCl reaccionan con Zn para producir ZnCl2 . ¿Qué cantidad, en gramos, de ZnCl2 se produce? P.A. (Cl=35,5; Zn = 65; H = 1) Resolución: Balanceando la ecuación química obtenemos: Zn + 2HCl → ZnCl2 + H2 1 mol 2 mol 1 mol 2 mol 136 g PMZnCl2 = 136 Pero se sabe que: 1 mol (HCl) → 6,02 x 1023 moléculas (HCl) x (HCl) → 3,612 x 1024 moléculas (HCl) x = moles (HCl) x = 6 moles (HCl) Luego: Zn + 2HCl → ZnCl2 + H2 2 mol 136 g 6 mol x g Resoviendo: x = g → x = 408 g de ZnCl2 3,612 x 1024 6,02 x 1023 La relación quiere decir que 2 moles de HCl al reaccionar con 1 mol (Zn) producen 136 g de ZnCl2 . 6 x 136 2 5. Se combinan 30 g de nitrógeno y 6 g de hidrógeno con la finalidad de producir amoniaco (NH3 ). ¿Qué cantidad del reactivo en exceso no reacciona? P.A. (N = 14; H = 1) Resolución: Según la reacción: 1N2 + 3H2 → 2NH3 1 mol 3 mol 2 mol 1(28) 3(2) 28 g 6 g De acuerdo a los datos tenemos 30 g de N2 y 6g de H2 , entonces el H2 es el reactivo limitante, y además el N2 es el reactivo en exceso, luego sobrará 2 g de N2 . 2 g de N2 Notamosque1moldeN2 reacciona exactamente con 3 moles de H2 para formar 2 moles de NH3 Notamos que en cantidades, 28 g de N2 reaccionan con 6 g de H2 . 2) ¿Cuántos gramos de zinc (P.A. = 65) se requieren para reaccionar con suficiente cantidad de ácido sulfúrico y producir 20 mol - g de hidrógeno, de acuerdo a la siguiente ecuación? Zn + H2 SO4 → ZnSO4 + H2 a) 65 g b) 650 g c) 1300 g d) 120 g e) 20 g 3) ¿Qué peso de oxígeno reacciona con 6 g de hidrógeno (H=1; O = 16)? H2 +1/2O2 → H2 O a) 48 g b) 32 g c) 16 g d) 30 g e) 6 g 4) ¿Qué peso de oxígeno se requiere para la combustión de 14 g de C2 H4 ? (H = 1; C = 12; O = 16) C2 H4 + 3O2 → 2CO2 + 2H2 O a) 40 g b) 44 g c) 48 g d) 50 g e) 53 g 5) ¿Qué peso de oxígeno se obtiene del calentamiento de 1225 g de clorato de potasio (K = 39; Cl = 35,5; O = 16)? 2KClO3 → 2KCl + 3O2 a) 96 g b) 400 g c) 122,5 g d) 480 g e) 1225 g
- 31. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 91 Educamos para la VIDA y también para la UNIVERSIDAD 16) En la siguiente reacción, ¿cuántos gramos de potasio se emplea para obtener 4g de H2 ? P.A. (K) = 39 K + HCl → KCl+ H2 a) 220 b) 200 c) 145 d) 249 e) 320 Nivel II 10) Indica cuántas moles de FeCl2 se produce con 3 moles de hierro puro en: Fe + CuCl2 → FeCl2 + Cu a) 6 b) 3 c) 5 d) 7 e) 10 6) ¿Qué peso de hierro puro se obtiene a partir de 2000 g de óxido férrico? Fe2 O3 + 3H2 → 2Fe + 3H2 O a) 56 g b) 25 g c) 112 g d) 1400 g e) 2000 g 7) ¿Cuántas moles de oxígeno se requieren para la combustión de 3 moles de C3 H8 ? 1C3 H8 + 5O2 → 3CO2 + 4H2 O a) 10 b) 15 c) 20 d) 25 e) 30 8) ¿Cuántas moles de amoniaco se produce con 6 moles de hidrógeno? 3H2 + 1N2 → 2NH3 a) 6 b) 4 c) 5 d) 7 e) 8 9) ¿Cuántas moles de oxígeno se necesita para producir 8 moles de NO en la siguiente reacción? 4NH3 + 5O2 → 4NO + 6H2 O a) 10 b) 15 c) 17 d) 22 e) 25 11) El 50% de CO2 producido en la combustión completa del propano es utilizado para producir hielo seco. Determina el peso de propano necesario para producir 1320 g de hielo seco. a) 66 g b) 1320 g c) 880 g d) 132 g e) 44 g 12) Al reaccionar 25 g de aluminio en exceso de ácido, ¿cuántos litros de gas hidrógeno se producirá a C.N.? Al + H2 SO4 → Al2 (SO4 )3 + H2 a) 31,1 b) 67,2 c) 25 d) 54 e) 24,4 13) ¿Cuál es el volumen de anhídrido carbónico, producido en la combustión completa de 12 litros de gas propano (C3 H8 ) realizado a C.N. ( C = 12 ; H = 1)? 1C3 H8 + 5O2 → 3CO2 + 4H2 O a) 30 L b) 36 L c) 39 L d) 42 L e) 51 L 14) Al descomponer 490 g de clorato de potasio, ¿cuántos litros de oxígeno a C.N. se podrán liberar? 2KClO3 → 2KCl+ 3O2 a) 230 b) 142 c) 134,4 d) 158,5 e) 320 15) Determina la cantidad de CO2 formado a partir de 500 g de CaCO3 en: CaCO3 → CaO + CO2 a) 220 g b) 200 g c) 145 g d) 249 g e) 320 g 18) ¿Cuántas moles de NH3 se forman por reacción de 60 g de hidrógeno? a) 20 b) 30 c) 42 d) 55 e) 63 17) ¿Cuántos gramos de H2 O se forma por combustión completa de 150 g de etano (C2 H6 )? C2 H6 + O2 → CO2 + H2 O a) 220 b) 200 c) 145 d) 249 e) 320 19) Para la combustión completa del metano (gas CH4 ) se forma 40L de gas. Halla el volumen de CH4 empleado. 1CH4 + 2O2 → 1CO2 + 2H2 O a) 1 L b) 40 L c) 120 L d) 3 L e) 6 L 20) Si reacciona 160 g de Ca en: Ca + HCl → CaCl2 + H2 , determina el volumen de hidrógeno formado a C.N. 1Ca+ 2HCl → 1CaCl2 + 1H2 a) 22,4 L b) 40 L c) 89,9 L d) 160 L e) 333 L 21) Determina la masa de O2(g) que sedesprendepordescomposición de 227 g de KClO4 , según la ecuación: KClO4 → KClO3 + 1/2O2 (K = 39; Cl = 35,5; O = 16) a) 16 g b) 48 g c) 72 g d) 32 g e) 64 g 22) ¿Cuánto de SO2 se formará por la quema de 480 g de pirita (FeS2 ), según la ecuación? FeS2 + O2 → Fe2 O3 + SO2 (Fe = 56; S = 32; O = 16) a) 64 g b) 320 g c) 400 g d) 960 g e) 512 g
- 32. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 92 Educamos para la VIDA y también para la UNIVERSIDAD 32) De acuerdo a la reacción: Fe2 O3 + HCl → FeCl3 + H2 O ¿cuántos gramos de Fe2 O3 deben reaccionar para formar 7,2 g de H2 O? Masa atómica (Fe = 56, O = 16, Cl = 35,5) a) 20,3 b) 21,3 c) 22,7 d) 23,7 e) 22,3 23) ¿Cuántas moles de amoniaco pueden reaccionar con 10 moles de O2 en la reacción? NH3 + O2 → NO + H2 O2 a) 8 b) 4 c) 5 d) 10 e) 15 24) ¿Qué volumen de oxígeno gaseoso O2 a C.N. se necesita para la combustión de 5 litros de metano (CH4 ) a C.N.? a) 5 L b) 10 L c) 15 L d) 20 L e) 7, 5 L 25) Indica cuántas moles de Cl2 deben reaccionar con ácido sulfhídrico para formar 49 g de H2 SO4 de acuerdo a: Cl2 + H2 S + H2 O → HCl + H2 SO4 (Cl = 35,5; S = 32; H = 1) a) 1 b) 0,5 c) 2 d) 2,5 e) 5 26) Para formar óxido de calcio se requiere de 40 g de calcio y 16 g de oxígeno. ¿Cuál es la masa del óxido? a) 50 g b) 52 g c) 54 g d) 56 g e) 58 g 27) De acuerdo a la reacción: P2 O5 + H2 O → H3 PO4 ¿Cuántas moles de H2 O reaccionan con 6 moles de P2 O5 ? a) 6 mol b) 3 mol c) 2 mol d) 18 mol e) 12 mol 28) ¿Cuántas moles de NH3 se forman a partir de 5 moles de N2 en: N2 + H2 → NH3 ? a) 10 b) 12 c) 15 d) 20 e) 25 29) Indica cuántas moles de KClO3 se deben descomponer para obtener 1,2 moles de O2 en: KClO3 → KCl + O2 a) 1,0 b) 1,2 c) 0,8 d) 0,75 e) 2,4 30) Halla la masa de agua que se requiere para que reaccione con 4,6 g de sodio según: Na + H2 O → NaOH + H2 Masa atómica (Na = 23, H = 1, O = 16) a) 5,4 g b) 3,6 g c) 2,7 g d) 1,8 g e) 1,5 g Nivel III 31) ¿Cuántos gramos de CO2 se forman de la combustión de 26 kg de C2 H2 ? a) 44 g b) 132 g c) 176 g d) 88 g e) 22 g 33) Según la reacción: NH3 + O2 → NO + H2 O ¿cuántosgramosdeNOseforman a partir de 3,5 mol de O2 ? a) 84 g b) 75 g c) 60 g d) 52 g e) 42 g 34) ¿Cuántas moles de HCl reacciona con 6,5 gramos de zinc? Zn + HCl → ZnCl2 + H2 Masa atómica (Zn = 65, H = 1, Cl = 35,5) a) 2,0 b) 1,8 c) 1,2 d) 0,4 e) 0,2 35) ¿Qué volumen de CO2 a condiciones normales se obtiene de la descomposición térmica de 50 g de CaCO3 ? CaCO3 → CaO + CO2 Masa atómica (Ca = 40, C = 12, O = 16) a) 11,2 L b) 22,4 L c) 33,6 L d) 44,8 L e) 56,0 L 36) ¿Qué volumen de CO2 a 1,64 atm y 127º C se forma de la combustión de 0,4 mol de gas acetileno: C2 H2 ? a) 10 L b) 12 L c) 14 L d) 16 L e) 20 L 37) De acuerdo a la reacción: CO + O2 → CO2 ¿cuántos litros de O2 a condicionesnormalesserequiere para que reaccione con 2,5 litros de CO? a) 5,0 b) 2,5 c) 1,25 d) 0,75 e) 0,25 38) Se coloca en un reactor 150 g de CaCO3 con 135 g de HCl. CaCO3 +HCl→CaCl2 +CO2 +H2 O ¿Quién es el reactivo en exceso? Masa atómica (Ca = 40; C = 12; O = 16; Cl = 35,5; H = 1) a) CaCO3 b) HCl c) CO2 d) H2 O e) No hay
- 33. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 93 Educamos para la VIDA y también para la UNIVERSIDAD 39) Según: C6 H12 O6 CO2 + C2 H5 OH ¿cuántos gramos de CO2 se forman de la fermentación de 9 g de C6 H12 O6 en un proceso cuya eficiencia es 75%? a) 4,4 b) 3,3 c) 2,2 d) 1,1 e) 0,8 enzima 40) De acuerdo a: Fe2 O3 + HCl3 → FeCl3 + H2 O ¿cuántos gramos de óxido férrico se deben tratar para formar 1,35 moles de H2 O en un proceso cuya eficiencia es 60%? a) 100 b) 110 c) 120 d) 150 e) 180 41) Al calentar 245 g de clorato de potasio se pierde 96 g de gas oxígeno. ¿Qué masa queda? a) 256 g b) 331 g c) 341 g d) 149 g e) 506 g 45) ¿Cuántos gramos de carburo de calcio CaC2 se debe agregar a 360 g de H2 O para formar gas acetileno? CaC2 +H2 O→C2 H2 +Ca(OH)2 Masa atómica (Ca = 40, C = 12, O = 16, H = 1) a) 320 b) 480 c) 640 d) 128 e) 360 42) Según: H2 + O2 → H2 O, ¿cuántosmolesdeH2 reaccionan con 6 moles de O2 ? a) 3 b) 6 c) 12 d) 14 e) 18 43) De acuerdo a: NH3 → N2 + H2 ¿cuántos moles de NH3 se deben descomponer para obtener 1,2 moles de N2 ? a) 0,6 b) 0,9 c) 1,2 d) 1,8 e) 2,4 44) En C3 H8 + O2 → CO2 + H2 O si se forman 1,6 moles de H2 O, ¿cuántos moles de CO2 se formaron? a) 1,2 b) 1,8 c) 2,4 d) 3,6 e) 4,8 46) ¿Cuántos gramos de CO2 se forman de la combustión de 8,8 g de gas propano C3 H8 ? a) 20,4 b) 17,6 c) 26,4 d) 17,9 e) 26,7 47) Se trata hidróxido de sodio (NaOH) con suficiente ácido clorhídrico HCl para formar 11,70gdeclorurodesodioNaCl. ¿Qué cantidad de hidróxido se usó? Masas atómicas (Na = 23; O = 16; Cl = 35,5; H = 1) a) 2 g b) 4 g c) 6 g d) 8 g e) 10 g 48) Respecto a las siguientes proposiciones: I. La estequiometría estudia al aspecto cualitativo de las reacciones químicas. II. Según Lavoisier, la masa de los reactantes es igual a la masa de los productos III. Según Proust, los reactantes se consumen en una proporción definida de masas. IV. La ley de combinación de volúmenes se aplica a presión y temperatura constante. Es (son) correcto(s) a) II y IV d) II, III y IV b) III e) I, II y III c) II y III 49) El magnesio, al reaccionar con el oxígeno desprende una luz brillante, similar a las luces de bengala. Sea la reacción siguiente: Mg(s) +O2(g) →MgO(s) Si reaccionan 1,2 g de magnesio puro con suficiente oxígeno, ¿qué cantidad de MgO se generará? P.A (Mg = 24, O = 16) a) 2 g b) 4 g c) 8 g d) 0,5 g e) 0,4 g 50) Suponga que para deshacerse de los 1,8 kg diarios de agua que excreta un astronauta, se aprovecha la reacción: Li2 O+H2 O→LiOH ¿qué masa de óxido de litio habría que introducir en la cápsula para un viaje de 15 días? P.A. (Li = 7, O = 16) a) 60 kg b) 45 kg c) 35 kg d) 62 kg e) 18 kg
- 34. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 94 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo Marcellin Pierre Berthelot Sintetizó por primera vez metano en un laboratorio. Nace en París (Francia), Marcellin Berthelot. Gobierno de Ramón Castilla. Inicio del gobierno de José de la Mar. 1827 1856 1907 1885 Gobierno de Miguel Iglesias. Publica su obra, Los orígenes de la alquimia. Gobierno de José Pardo y Barreda. Muere en Francia, Marcellin Berthelot.
- 35. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 95 Educamos para la VIDA y también para la UNIVERSIDAD Es el porcentaje que representa el peso o volumen práctico obtenido, con respecto al peso o volumen teórico. RENDIMIENTO O EFICIENCIA DE UNA REACCIÓN QUÍMICA * Para pesos * Para volúmenes ¿Cómo reconocer a la sustancia limitante? R = x 100 WP WT SUSTANCIA LIMITANTE Es aquella sustancia que limita una reacción, o sea, la reacción finaliza cuando se termina esta sustancia. Para reconocer la sustancia limitante teniendo la ecuación balanceada y conociendo los pesos tomados de cada reactante, se dividirá el peso tomado de cada reactante entre su respectivo peso estequiométrico; allí donde resulta la menor cantidad se tendrá al reactivo limitante. Si reaccionan 100g de N2 y 100 g de H2 , ¿cuánto NH3 producen? N2 + 3H2 → 2NH3 100g 100g x 28g 6g 34g 1mol 3moles 2 moles Ejemplo: R = x 100 VP VT ¿Cómo se forman las caries dentales? Elesmaltedentalesuncompuesto básico (hidroxiapatita), por lo que es atacado y destruido por los ácidos. Aunque la saliva es neutra, las bacterias presentes en la boca descomponen los restos de alimentos atrapados entre los dientes, produciéndose sustancias ácidas. El azúcar es especialmente peligroso, ya que en mano de dichas bacterias termina dando ácido láctico, que termina por disolver el esmalte. ¿Por qué se seca la ropa más deprisa cuando hay viento que cuando no hay? Al haber viento, aumenta la velocidad de las moléculas de agua de la ropa y, por tanto, se desprenden más fácilmente de la ropa húmeda. Estequiometría II
- 36. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 96 Educamos para la VIDA y también para la UNIVERSIDAD ¿Por qué al pelar las manzanas éstas forman o toman un color marrón? Las manzanas contienen unas sustancias llamadas polifenoles. Al pelarlas, permites que reaccionen con el oxígeno del aire. Gracias a unas enzimas que contiene la manzana, tienen lugar unas complicadas reacciones químicas de polimeración debido a las cuales se forma un pigmento marrón. = 3,57 Limitante ⇒ H2 = 100 6 = 16,7 Exceso ∴ = W = 121,4 g de NH3 SUSTANCIA EN EXCESO Es aquella sustancia que se halla en mayor proporción y se reconoce al consumirse el reactivo limitante, ya de que ésta aún sobrará una cantidad. CONTRACCIÓN VOLUMÉTRICA Es la disminución del volumen que experimentan las sustancias gaseosas al reaccionar, que es igual a: Donde: VR : Volumen total de reactantes VP : Volumen total de productos i) En la reacción: N2 + 3H2 → 2NH3 10L 30L 20L CV = = =40L - 20L 40L 20L 40L ∴ Contracción volumétrica 1/2 ii) 1H2(g) + 1I2(g) → 2HI(g) CV = 0 iii) 2H2(g) + 1O2(g) → 2H2 O(g) CV = iv) 1N2(g) + 3H2(g) → 2NH3(g) CV = v) H2(g) + Cl2(g) → 2HCl(g) CV = 0 1 3 CV = VR - VP VR ¿Por qué no se quema nada en la Luna? Al no haber oxígeno presente, no se puede dar una reacción de combustión. Ejemplo: 1 2 1 2 100 28 100 1 x 28 W 2 x 17 ⇒ N2 =
- 37. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 97 Educamos para la VIDA y también para la UNIVERSIDAD 1) Se dispone de 200 g de una muestra que contiene 52% de BaCl2 . Al reaccionar esta muestra con 56g de H2 SO4 concentrado, ¿qué cantidad de BaSO4 precipita? P.A. (Ba = 137, S = 32, O = 16 , H = 1) BaCl2(ac) + H2 SO4(ac) → BaSO4(S) + HCl(ac) De la muestra se tiene que del total sólo el 52% es BaCl2 , entonces hallando la cantidad de BaCl2 obtenemos: WBaCl2 = 52%(200g) = 104g Luego para relacionar las cantidades, conviene trabajar con la relación de moles. Para hacer esto, la ecuación tiene que estar balanceada. luego notamos que para 208 g de BaCl2 se necesita 98g de H2 SO4 , entonces: con este dato hallado notamos que hay un reactivo en exceso (H2 SO4 ) ⇒ en la reacción: BaCl2(ac) + H2 SO4(ac) → BaSO4(S) + 2HCl(ac) Por una simple relación, entonces: Resolución: BaCl2(ac) + H2 SO4(ac) → BaSO4(S) + 2HCl(ac) 1 mol 208g 104g { Dato 1 mol 98g 56g Dato 1 mol 233g WBaSO4 PM BaCl2 = 208 PM H2 SO4 = 98 PM BaSO4 = 233 { 208 → 98 104 → WH2SO4 ⇒ 104 x 98 208 WH2SO4 = WH2SO4 = 49 g 208 g 104 g 233 g WBa2SO4 WBa2SO4 = 116,5 g 233 x 104 208 WBa2SO4 = 2) ¿Qué volumen de O2 se necesita para la combustión de 132 g de gas propano (C3 H8 ) si la eficiencia de la reacción es 98%? P.A. (C = 12, O = 16, H = 1) C3 H8 + 5O2 → 3CO2 + 4H2 O Primero hallamos los pesos moleculares: PM (C3 H8 )= 3(12) + 8(1) = 44 PM (O2 ) = 2(16) = 32 Luego en la reacción: C3 H8 + 5O2 → 3CO2 + 4H2 O 1 mol 5 mol ⇒ Esta relación molar quiere decir 1 mol de C3 H8 reacciona exactamente con 5 moles de O2. . Entonces: 1mol(C3 H8 ) 1(44g) 44g(C3 H8 ) 132gC3 H8 5 mol (O2 ) 5(32)g 160g(O2 ) WO2 Resolución: * Luego por una simple relación, hallaremos el WO2 Dato: WO2 = 132 x 160 44 Pero este peso está al 100% y por dato la reacción se efectúa a un 98%, entonces: ⇒ 98%(480)g = 470,4g de O2 WO2 = 480 g
- 38. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 98 Educamos para la VIDA y también para la UNIVERSIDAD 3) Por el proceso Haber se sintetiza NH3 (amoniaco) utilizando nitrógeno e hidrógeno de la siguiente manera: N2 + 3H2 → 2NH3 . Si tenemos 100g de nitrógeno al 98% de pureza, ¿qué cantidad de NH3 se formará? N2 + 3H2 → 2NH3 1 mol 3mol 2mol 28g 2(17)g 28g 34g PMN2 = 28 PMNH3 = 17 hemos relacionado moles y masa molecular con el fin de hallar una relación de masas apropiada. Obs.: Cuando nos dicen nitrógeno al 98% se refiere que hay una mezcla de gases en la cual el 98% del total es nitrógeno. N2 + 3H2 → 2NH3 28g 34g WN2 WNH3 hallando la masa de N2 . ⇒ 98%(100g) = WN2 98g = WN2 34 x WN2 28 34 x 98 28 4) Según la reacción 2HNO3(ac) + 3H2 S(ac) → 2NO(g) + 3S(s) + 4H2 O(l) Se tiene 42,14 x 1023 moléculas de HNO3 , de acuerdo a esto, ¿cuántos litros de NO(g) se obtiene a 67°C y 7 atm de presión? P.A. (N = 14; S = 32; H = 1; O = 16) Nos dan 42,14 x 1023 moléculas de HNO3 , luego sabemos: 1 mol HNO3 <>6,02 x 1023 moléculas HNO3 x moles HNO3 <> 42,14 x 1023 moléculas HNO3 x = ⇒ x = 7 moles 42,14 x 1023 6,02x 1023 Hemos hallado el número de moles que participan en la reacción. Luego: 2HNO3(ac) + 3H2 S(ac) → 2NO(g) + 3S(s) + 4H2 O(l) 2mol 2mol 7 moles y mol } Relacionando el número de moles y = 7 x 2 2 ⇒ y = 7 moles NO(g) Para hallar el volumen de NO(g) se utilizará PV = nRT. P = 7 atm V = ? n = 14 moles T = 67°C = (67+273)K=340K R = 0,082 atm.L/mol-g.K ya que la presión está en atm. PV = nRT 7V =(7) (0,082) (340) V = 27,88 L 5) Si la siguiente reacción KClO3(s) → KCl(s) + O2(g) se efectúa a condiciones normales (C.N.) ¿qué volumen de oxígeno se produce con 735 g de KClO3 ? P.A.(K = 39 ; Cl = 35,5 ; O = 16) Si la reacción KClO3 → KCl + O2 se trabaja tal como está, encontraremos valoresinadecuadosyaquelaecuación química no está balanceada. balanceando: 2KClO3 → KCl + 3O2 R. de moles: 2 mol 3 mol R. masa-moles: 2(122,5)g 3 mol PM KClO3 = 122,5 Luego de haber relacionado las masas con el número de moles apropiado, procedemos a trabajar con dicho número de moles. 245 g 3 mol 735 g x mol x = 735 x 3 245 x = 9 moles Sabemos que para cualquier gas que está sometido a condiciones normales 1 mol de dicho gas ocupa 22,4 litros, entonces: 1 mol (O2 ) Valor hallado → 9 mol(O2 ) 22,4L VL → V = C.N. 9 x 22,4 1 ⇒ V = 201,6L 245g 3 mol Dato: 735g x mol Resolución: Resolución: WNH3 = WNH3 = WNH3 = 119 g Resolución:
- 39. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 99 Educamos para la VIDA y también para la UNIVERSIDAD 9) 200 g de un mineral que tiene una pureza de 80 % correspondiente al CaCO3 se descompone de acuerdo a la siguiente reacción: CaCO3 → CaO + CO2 Halla el peso de óxido de calcio que se obtiene. (Ca = 40 ; C = 12; O = 16) a) 90 g b) 100 g c) 95 g d) 97 g e) 88 g Nivel I 1) ¿Cuántos moles de óxido ferroso se formarán a partir de 6 moles de hierro?(Fe = 56) Fe + O2 → FeO a) 5 b) 6 c) 7 d) 8 e) 10 2) Halla el número de moles de agua que se forman al quemarse 5 moles de metano. CH4 + O2 → CO2 + H2 O a) 20 b) 30 c) 10 d) 50 e) 60 3) ¿Qué masa de agua se formará a partir de 2g de hidrógeno? H2 + O2 → H2 O a) 36g b) 9g c) 18g d) 28g e) 36g 4) Para la reacción: H2 + N2 → NH3 ,secombina13gdehidrógeno con una determinada cantidad de nitrógeno. Halla el número de moles de amoniaco que se obtiene. (N = 14; H = 1) a) 2 b) 4 c) 3 d) 6 e) 7 5) ¿Qué masa de anhídrido sulfúrico se necesita para preparar 196g de ácido sulfúrico? (S = 32) SO3 + H2 O → H2 SO4 a) 160 g b) 82 g c) 18 g d) 136 g e) 80 g 6) ¿Cuántas moles de H2 O se forma a partir de 40g de H2 ? H2 + O2 → H2 O a) 10 b) 20 c) 30 d) 40 e) 50 7) De acuerdo a la ecuación: C + H2 O → CO + H2 Determina cuántas moles de carbono se necesita para preparar 6g de H2 . a) 1 b) 2 c) 3 d) 4 e) 5 8) ¿Cuántas moles de HCl se forman a partir de 20g de hidrógeno? H2 + Cl2 → HCl a) 30 b) 20 c) 10 d) 5 e) 60 10) ¿Qué peso de hidrógeno se obtiene a partir de 48 g de magnesio de si la eficiencia de la reacciónes60%? (Mg = 24; H = 1) Mg + 2HCl → MgCl2 + H2 a) 4 g b) 2,4 g c) 3,8 g d) 5 g e) 6,4 g 11) ¿Qué peso de hidróxido de sodio se obtiene a partir de 92g de sodio si el rendimiento de la reacción es 70%? (Na=23 ; O=16 ; H = 1) 2Na + 2H2 O → 2NaOH + 1H2 a) 160 g b) 112 g c) 140 g d) 70 g e) 80 g 12) 490g de un mineral que contiene 50% de pureza de clorato de potasio se descompone de acuerdo a la siguiente reacción: KClO3 → KCl + O2 Halla el peso de oxígeno que se desprende. a) 90 g b) 96 g c) 86 g d) 64 g e) 98 g 13) En la siguiente reacción: CaCO3 → CaO+CO2 (Ca = 40 ; O = 16; C = 12) se descompone 400g de carbonato de calcio (CaCO3 ). ¿Cuántos gramos de dióxido de carbono se obtiene si la eficiencia es del 50%? a) 88 b) 22 c) 33 d) 44 e) 48
- 40. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 100 Educamos para la VIDA y también para la UNIVERSIDAD Nivel II 14) Se hace reaccionar 16g de hidrógeno con 16g de oxígeno. Determina: * La sustancia limitante * El peso de la sustancia en exceso * El peso de agua formado 2H2 + 1O2 → 2H2 O 15) Se hace reaccionar 20g de magnesio con 8g de oxígeno. Determina la sustancia limitante y el peso de la sustancia que queda sin reaccionar. (Mg = 24; O = 16) 2Mg + 1O2 → 2MgO a) O2 ;32 g d) Mg; 0,2 g b) Mg; 0,4 g e) O2 ; 8 g c) Mg; 12 g 16) Se hace reaccionar 10,08 g de hierro y 5,12g de azufre. Determina el peso de la sustancia en exceso. (Fe = 56 ; S = 32) Fe + S → FeS a) 8,96 g b) 1,12 g c) 10,08g d) 5,12 g e) 4,22 g 17) Se hace reaccionar 42g de nitrógeno con 15g de hidrógeno. ¿Qué peso de amoniaco se formará? (N = 14; H = 1) a) 51 g b) 42 g c) 17 g d) 28 g e) 34 g 18) ¿Qué volumen de amoniaco (NH3 ) se formará a partir de 12 litros de H2 gaseoso? N2 + H2 → NH3 a) 8 L b) 4 L c) 12 L d) 6 L e) 18 L 19) Determina el volumen de oxígeno gaseoso que se ha empleado para liberar 100 litros de CO2 , de acuerdo a: C2 H4 + O2 → CO2 + H2 O a) 100L b) 180L c) 50L d) 200L e) 300L 20) Halla los volúmenes de nitrógeno e hidrógeno necesarios para producir 1000 litros de amoniaco (NH3 ). N2 + H2 → NH3 a) VN 2 = 1500L VN 2 = 500L b) VN 2 = 500L VN 2 = 500L c) VN 2 = 500L VN 2 = 1500L d) VN 2 = 1500L VN 2 = 1500L e) VN 2 = 800L VN 2 = 200L 21) ¿Qué volumen de H2 a 27°C y 6 atm reaccionará con 5L de N2 a 227°C y 4 atm en la síntesis de amoniaco? a) 15 L b) 12 L c) 5 L d) 6 L e) 3 L 22) ¿Qué masa de carbón de 60% de pureza deberá quemarse para formar 560g de monóxido de carbono? C + O2 → CO a) 600 g b) 800 g c) 288 g d) 240 g e) 400 g 23) ¿Cuántos gramos de agua se formará si reaccionan? totalmente 40g de oxígeno con suficiente cantidad de hidrógeno si la eficiencia de la reacción es de 60%? H2 + O2 → H2 O a) 24 b) 25 c) 26 d) 27 e) 28 24) ¿Cuántos gramos de amoniaco se formará cuando se combinan 56g de nitrógeno con 24g de hidrógeno? H2 + N2 → NH3 a) 33 b) 34 c) 68 d) 17 e) N.A. 25) ¿Cuántos gramos de agua se formará al reaccionar 8 gramos de oxígeno y 8 gramos de hidrógeno? H2 + O2 → H2 O a) 8 b) 10 c) 12 d) 32 e) 44 26) En la reacción: Na + H2 O→ Na(OH) + H2 Si se forman 8 gramos de NaOH, ¿cuántos gramos de gas H2 se liberó? a) 0,1 b) 0,2 c) 0,5 d) 0,8 e) 1,0 27) De acuerdo a la reacción: Al + HCl→ AlCl3 + H2 ¿Cuántas moles de hidrógeno gaseoso: (H2 ) se forman con 5,4g de Aluminio: (Al)? Masa atómica: Al = 27 a) 1,5 b) 1,2 c) 3,0 d) 3,6 e) 0,3
- 41. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 101 Educamos para la VIDA y también para la UNIVERSIDAD 28) ¿Cuántos gramos de ácido nítrico HNO3 reaccionan con 6,4 mol-g de cobre según: 3Cu +8HNO3 → 3Cu(NO3 )2 + 2NO + 4H2 O Masa atómica: (Cu=63,5; N=14; O=16; H=1) a) 1075,2 d) 2063,2 b) 3075,5 e) 4000 c) 4008 Nivel III 29) De acuerdo a la reacción: NH3 +O2 → NO + H2 O ¿Cuántos moles de oxígeno gaseoso O2 reaccionan con 6,8g de NH3 ? a) 0,4 b) 0,5 c) 0,6 d) 0,7 e) 0,8 30) ¿Cuántos litros de O2 reaccionan con 6L de H2 a las mismas condiciones, para formar H2 O? a) 12 b) 10 c) 4 d) 3 e) 2 31) ¿Cuántos litros de NH3 se forman de la síntesis de 8L de N2 con suficiente cantidad de H2 ? a) 8 b) 16 c) 20 d) 24 e) 30 32) Halla el volumen de CO2 a condiciones normales, que se obtiene por descomposición térmica de 10g CaCO3 . CaCO3 → CaO +CO2 Masa atómica: (Ca=40, C=12, O=16) a) 1,12L b) 2,24L c) 3,36L d) 5,4L e) 5,6L 33) ¿Qué volumen de O2 a 1,64 atm y 127°C se obtiene por descomposición de 0,4 moles de KClO3 ? 2KClO3 → 2KCl +3O2 a) 10L b) 11L c) 12L d) 15L e) 20L 34) Halla las moles de la sal. I. Se tiene 400g de CaCO3 en la reacción: CaCO3 → CaO +CO2 35) Halla los gramos del óxido de calcio. 36) Halla los gramos del dióxido de carbono. 37) Halla el volumen a C.N. del CO2 . 38) Las pinturas antiguas al óleo se oscurecen debido al sulfuro de plomo (II), que se forma por reacción del plomo con el sulfuro de hidrógeno que se encuentra en pequeñas cantidades en el aire contaminado. La reacción química es: Pb(S) +H2 S(g) → PbS(S) + H2(g) Si en la pintura existen 4,14g de Pb, ¿qué peso de PbS se produce? P.A. (Pb=207, S=32) a) 5,6 g b) 3,6 g c) 7,5 g d) 4,78 g e) 8,25 g 39) Para disolver el “caliche” de ciertas tuberías se utiliza ácido clorhídrico,(HCl), el cuál reacciona de la siguiente manera: HCl+CaCO3 →CaCl2 +CO2 + H2 O ¿Qué masa de CO2 se produce si se utilizó 610 g de HCl al 60% de pureza? P.A. (Cl=35,5 ; O=16, C=12) a) 320,8 g d) 220,6 g b) 150,6 g e) 380,6 g c) 425,8 g 40) Al combustionar 2,3 kg de alcohol etílico, ¿qué masa de aire se consume? C2 H5 OH(l) +O2(g) → CO2(g) + H2 O Aire: 20% mol O2 y 80% mol N2 M aire = 28,8 a) 25,8 kg d) 28,8 kg b) 32,6 kg e) 42,6 kg c) 21,6 kg 41) Cuando se requiere refinar una mena de cobre que contiene óxido cuproso se da la siguiente reacción: Cu2 O(s) +C(s) → Cu(s) + CO2(g) Si se tiene 395 g de Cu2 O y 140 g de carbono, indica el reactivo en exceso y la masa de CO2 que se forma. Dato: P.A. (Cu=63,5) a) 320,8 g d) 272 g b) 120,6 g e) 175,3 g c) 126,6 g 42) La hidracina, (N2 H4 ) y el tetróxido de dinitrógeno, (N2 O4 ), reaccionan violentamente y liberan buena cantidad de gases y por ellos se emplea como propulsor de cohetes. N2 H4 +N2 O4(g) → N2(g) +H2 O(g) A partir de 160 kg de N2 H4 y 250 kg de N2 O4 . ¿Qué peso de N2 se libera? a) 210 kg d) 180 kg b) 95 kg e) 120 kg c) 160 kg
- 42. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 102 Educamos para la VIDA y también para la UNIVERSIDAD 43) Muchas fábricas que liberan SO2 , utilizan un proceso denominado lavado húmedo para evitar la contaminación, el cual se indica a continuación: SO2 +Ca(OH)2 → CaSO3 +H2 O Si se utilizan 200g de Ca(OH)2 al 74%depureza,¿cuántosgramosde SO2 se puede eliminar? a) 160 g d) 320 g b) 32 g e) 64 g c) 128 g 44) En el motor de los cohetes que colocan satélites artificiales se utiliza una mezcla líquida de hidracina (N2 H4 ) y peróxido de hidrógeno(H2 O2 )quealreaccionar espontáneamentelohaceenforma explosiva ya que es una reacción fuertemente exotérmica. N2 H4 +H2 O2 → N2(g) +H2 O(g) A partir de 640g de hidracina, qué volumen de N2 se puede recolectar medidos a 127°C y 8,2 atm de presión. P. A. (N=14) a) 90 L d) 120 L b) 80 L e) 60 L c) 40 L 45) Elgastóxicomonóxidodecarbono se produce cuando se queman combustibles fósiles como el petróleo. El CO se convierte finalmenteenCO2 enlaatmósfera. Existen ciertos convertidores catalíticos de los automóviles que están diseñados para acelerar esta conversión: CO(g) +O2(g) → CO2(g) Si se utiliza 1 120 L de CO a C.N., ¿cuál es la masa del CO2 formado a C.N.? a) 4,4 kg d) 2,2 kg b) 8,8 kg e) 6,6 kg c) 6,25 kg 46) El carbón mineral que se quema en las centrales termoeléctricas contienen alrededor de 1,2% en peso de azufre, además en la combustión del crudo el azufre se transforma según: S(s) +O2(g) → SO2(g) Si se quema 640 kg de carbón mineral, ¿qué volumen de SO2 se produce a condiciones normales con un rendimiento de 80%? a) 4,3 m3 d) 6,5 m3 b) 8 m3 e) 2,5 m3 c) 3,3 m3 47) Se trata 11,2 g de hierro metálico con ácido clorhídrico al 36,5 % en peso y cuya densidad es 1,1 g/ mL. ¿Qué volumen de ácido se consume? Fe(s) +HCl(ac) → FeCl2(ac) +H2(g) P.A. (Fe=56; Cl=35,5) a) 18,6 L d) 32,6 L b) 40 mL e) 36,36 mL c) 22,4 mL 48) Enlosviajesespacialesesnecesario incluir una sustancia que elimine CO2 , producto de la respiración de los ocupantes, para ello se emplea LiOH, siendo la ecuación química: LiOH+CO2 → Li2 CO3 +H2 O ¿Qué peso de Li2 CO3 se produce a partir de 220 g de CO2 con un rendimiento del 75%? P.A. (Li=7) a) 360,5 g d) 160,2 g b) 126,7 g e) 325,5 g c) 277,5 g 49) El metanol (CH3 OH) se utiliza como combustible para autos de carrera. Se quema en el motor de combustión según la reacción: CH3 OH+O2(g) →CO2(g) +H2 O(g) A partir de 400 g de CH3 OH y 612 g de O2 se han producido 450 g de CO2 . ¿Cuál es la eficiencia del proceso? a) 92,6 % d) 81,8 % b) 75 % e) 60 % c) 62,5 % 50) En las soldaduras se emplean sopletes de oxiacetileno que puede alcanzar temperaturas de 2000°C, laelevadatemperaturaesproducto de la combustión del acetileno según: C2 H2(g) +O2(g) →CO2(g) +H2 O(g) Si se quema 100 L de acetileno, ¿qué volumen de aire se debe consumir? Aire: 20% Vol O2 , 80% Vol N2 a) 1250 L d) 2500 L b) 965 L e) 1625 L c) 1825 L
- 43. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 103 Educamos para la VIDA y también para la UNIVERSIDAD Línea deTiempo Linus Carl Pauling Publicó su obra La Naturaleza del Enlace Químico. Nace Linus Carl Pauling en Oregon (EE.UU). Fin del gobierno de Óscar R. Benavides. Gobierno de Eduardo López de Romaña. 1901 1939 1962 1954 Gobierno de Manuel A. Odría. Recibe el premio Nobel de química por su investigación de la estructura atómica de las proteínas, incluyendo la hemoglobina. Gobierno de Alberto Fujimori. Recibe el premio Nobel de la Paz. 1994 Muere, Linus Carl Pauling en EE.UU. Manuel Prado Ugarteche.
- 44. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 104 Educamos para la VIDA y también para la UNIVERSIDAD Es el proceso de combinación química del elemento. Es la cantidad de la sustancia que se cambia o desplaza una parte en masa de H, 8 en masa de oxígeno o 35,5 partes en masa de Cl. El peso equivalente no tiene unidad. 1. CONCEPTO 2. REGLAS Peq (O2 ) = 8 Peq (H2 ) = 1 Peq (Cl2 ) = 35,5 Relación de Masa: 1C + 1O2 → 1CO2 Relación de Peq: Peq(O) =8 → Peq(C)= 3 Ejemplos: 12g 32g a. En un elemento (E) Depende del Z y la valencia. Peq(E) = Z Valencia b. En un compuesto Depende del peso molecular (M) (parámetro numérico que depende de cada especie). Peq = M q Si participa en una reacción no rédox, se calcula así: Compuesto Valor de q (por unidad fórmula) Ácido q = Número de H ionizable o sustituidos. Hidróxido q = Número de OH ionizables o sustituidos. Óxido y Sal q = |Carga total del catión o anión| (Oxígeno o sales) c. En un Agente (oxidante o reductor) Puede ser compuesto o elemento, en forma molecular o iónica. Se calcula para cada partícula según: q =Número e¯ ganados o perdidos por unidad fórmula. Peq = M q Ejemplos: En un elemento: Sean Ca, CuO, Cu2 O y Fe+2 , halla el Peq de cada elemento. Se calcula para cada átomo y para el calcio se calcula el Peq resultando. Peq(Ca)= = 20 40 2 Peq(O)=16/2=8 CuO Peq(Cu)=63,5/2=31,75 +2 - 2 Peq(Cu)=63,5/1=63,5 Peq(Fe)=56/2=28 +1 +2 Fe En un compuesto: Los ácidos, hidróxidos y sales, reaccionan con mayor rapidez al estar disueltos en agua, donde se encuentran en forma de iones. Halla el Peq de HNO3 , H2 SO4 , Ca(OH)2 y K2 Cr2 O7 . CuO - 2 Peso Equivalente
- 45. CHICLAYO - LAMBAYEQUE - FERREÑAFE III Bim. / QUÍMICA / 5TO. AÑO 105 Educamos para la VIDA y también para la UNIVERSIDAD Entre los siglos III a.C. y el siglo XVI d.C la química estaba dominada por la alquimia. El objetivo de investigación más conocido de la alquimia era la búsqueda de la piedra filosofal, un método hipotético capaz de transformar los metales en oro. En la investigación alquímica se desarrollaron nuevos productos químicos y métodos para la separación de elementos químicos. De este modo se fueron asentando los pilares básicos para el desarrollo de una futura química experimental. Peq (HNO3 )= = 63 Peq (H2 SO4 )= = 49 Peq (Ca(OH)2 )= = 37 Peq (K2 Cr2 O7 )= = 147 63 1 98 2 74 2 294 2 En un agente: Halla el Peq del NH3 en NH3 + CuO → N2 + Cu +H2 O 1NH3 + CuO → N+ Cu +H2 O1 2 -3 0 -3e- Peq (NH3 ) = 17/3 = 5,7 3. EQUIVALENTE GRAMO O EQUIVALENTE (Eq - g) Es la masa en gramos de una sustancia que se combina o desplaza 1g de H, 8g de O o 35,5g de Cl. En rédox es la masa en gramos de una sustancia oxidante que gana o pierde 6,022 x 1023 e¯. 1Eq − g = Peq - gramo Ejemplo: 1Eq − g(O2 ) = 8g 4. NÚMERO DE EQUIVALENTE GRAMO (#Eq - g) Es el múltiplo o submúltiplo de 1 Eq− g, que está presente en una muestra química. 1Eq − g = W . (q) Peq W: masa Ejemplo: 5Eq − g(Ca) = 5 x 20g = 100g 0,3Eq − g(Ca) = 0,3 x 20g = 6g 1Eq − g(Ca) = 20g 5. LEY DE EQUIVALENCIA: Se aplica en reacciones químicas (las sustancias combinadas forman igual número de equivalente gramo). Si la reacción fuera A + B → C + D W(A) Peq(A) W: peso W(B) Peq(B) W(C) Peq(C) W(D) Peq(D) = = = Ejemplo: ¿CuántosgramosdeNasecombinan con 19,6g de H3 PO4 , sabiendo que la sal producida es Na2 HPO4 ? La ecuación sin balancear es: Na + H3 PO4 → Na2 HPO4 + H2 m 23 1 Ley: = ∴ 9,2 de Na se consume. 196 98 2
- 46. III Bim. / QUÍMICA / 5TO. AÑO CHICLAYO - LAMBAYEQUE - FERREÑAFE 106 Educamos para la VIDA y también para la UNIVERSIDAD Nivel I 1) ¿El equivalente gramo siempre es el peso molecular en gramos? 6) ¿El Peq no depende del tipo de reacción química? 10) Halla el equivalente gramo de una sustancia al disolverse en agua, sabiendo que participa en una reacción de metátesis: K2 Cr2 O7 . 11) Halla el equivalente gramo de una sustancia al disolverse en agua, sabiendo que participa en una reacción de metátesis CuSO4 . 5H2 O 2) ¿El peso equivalente del O es 8 ? 3) ¿La ley de equivalente se aplica para cualquier tipo de reacción química rédox ? 4) ¿Para KMnO4 , el parámetro q es igual a 7 cuando se reduce a MnO2 ? 5) ¿El peso equivalente de H3 PO3 puede tomar 3 valores, según el número de H+ liberados? 7) ¿En HNO3 (ac) → H+1 (ac) + NO3 -1 (ac), el Peq del ácido es igual a la suma del peso equivalente de sus iones ? 8) ¿Al combinarse 2Eq – g de ácido con 0,8 Eq – g de hidróxido se producen 2,8 Eq – g de sal? 9) ¿Al oxidarse el He pierde 4 moles de e¯, entonces se consumen 4g de aquel? 12) Halla el número de equivalentes gramo contenidos en 4,76g de MnO4 ¯, al participar como agente oxidante en: I. Medio básico; II Medio ácido. 13) Halla el Peq del H2 O y del nitrógeno en la reacción: NH3 O2 →H2 O +N2 • R e s p o n d e l a s p r e g u n t a s sustentando tu respuesta.