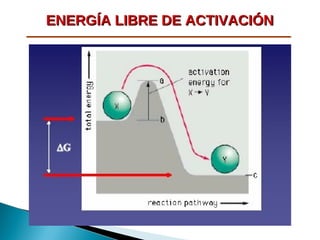
La bioenergética estudia los cambios de energía en reacciones bioquímicas. Existen tres tipos de sistemas: aislados, cerrados y abiertos. La primera ley de la termodinámica establece que la energía total se conserva. La segunda ley indica que los procesos espontáneos tienden a aumentar la entropía. La energía libre de Gibbs es un indicador de espontaneidad para sistemas biológicos abiertos, donde los procesos con ∆G negativo son espontáneos.