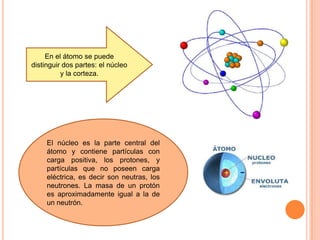
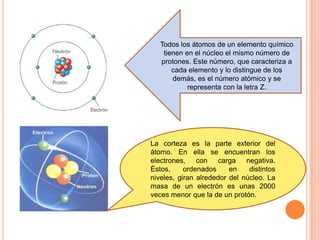
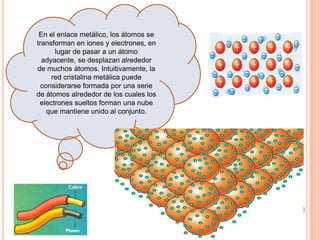
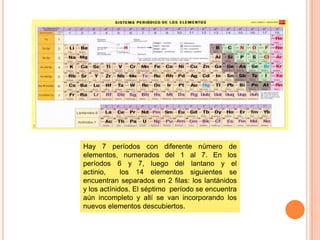
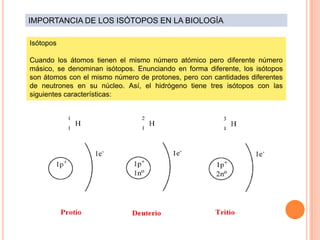
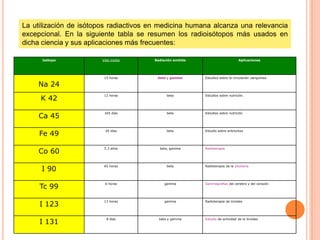
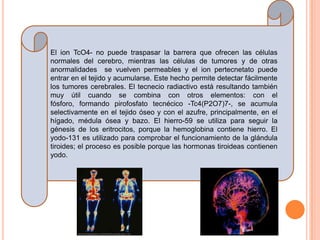
El documento describe la estructura del átomo, incluyendo el núcleo y los electrones. Explica los diferentes tipos de enlaces químicos como iónico, covalente y metálico. También cubre la tabla periódica y los grupos de elementos, e introduce los isótopos y sus aplicaciones importantes en biología como trazadores radioactivos.