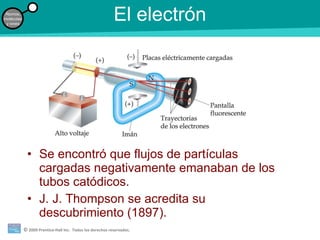
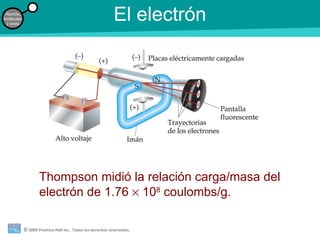
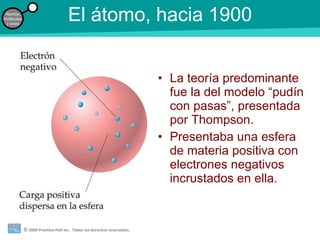
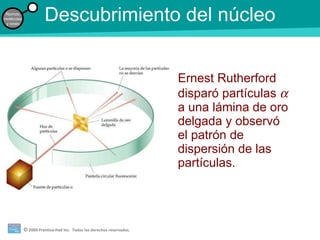
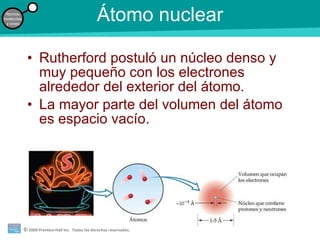
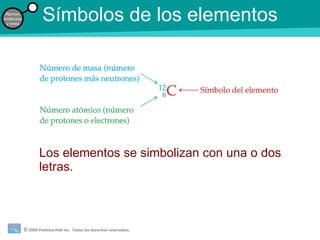
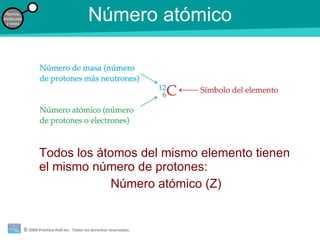
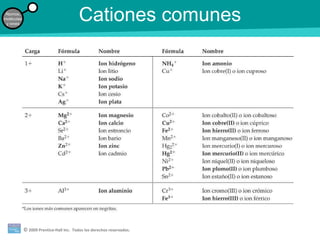
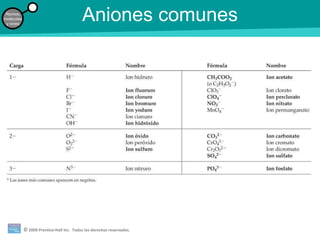
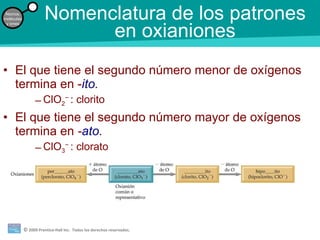
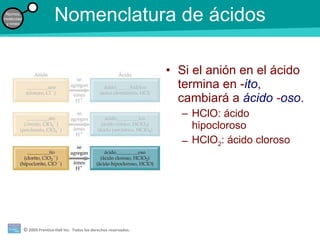
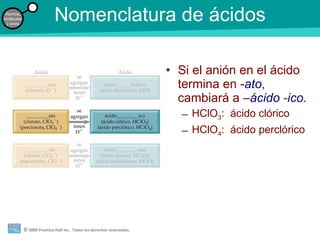
La teoría atómica de la materia fue defendida por John Dalton a inicios del siglo XIX. Postuló que los elementos están compuestos de átomos idénticos y que los átomos no se crean ni destruyen en reacciones químicas. Más tarde, científicos como J.J. Thompson, Ernest Rutherford y otros descubrieron partículas subatómicas como el electrón, protón y neutrón y desarrollaron el modelo atómico moderno con un núcleo central y electrones orbitando alrededor.