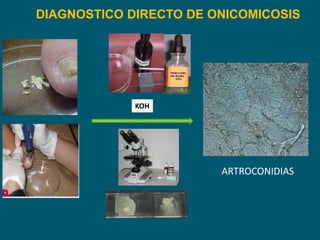
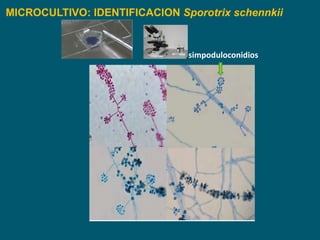
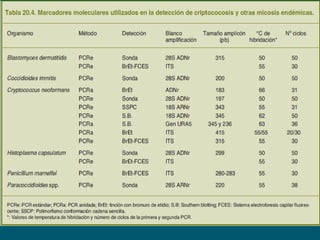
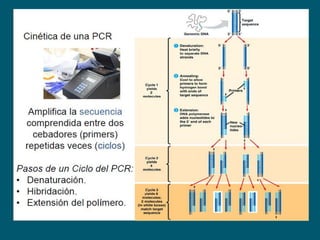
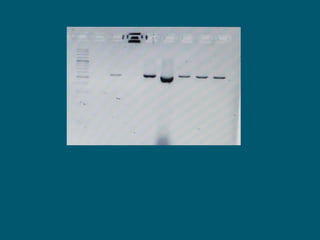
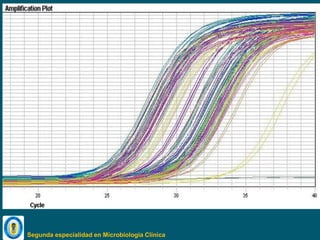
Este documento describe procedimientos de laboratorio para el aislamiento e identificación de hongos. Explica cómo realizar exámenes directos, cultivos y pruebas serológicas y moleculares en muestras de piel, uñas, pelo, esputo y otros fluidos corporales para diagnosticar infecciones fúngicas como dermatofitosis, candidiasis y criptococosis. Además, detalla técnicas de microscopía, cultivo en medios selectivos y uso de la reacción en cadena de la polimerasa para identificar