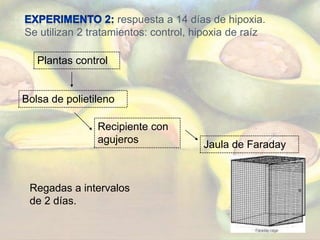
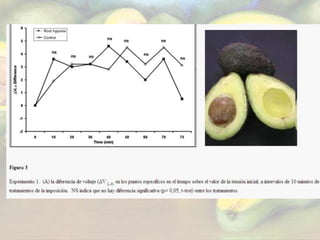
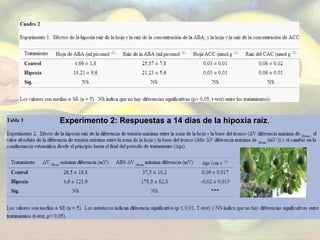
El estudio evaluó las respuestas fisiológicas de árboles de aguacate a corto y largo plazo ante hipoxia en las raíces, incluyendo señales eléctricas, conductancia estomática, concentraciones de ABA y etileno, y abscisión de hojas. Los resultados mostraron que a corto plazo no hubo cambios significativos, mientras que a largo plazo se redujo la conductancia estomática, aumentaron las emisiones de etileno en hojas y la abscisión foliar.