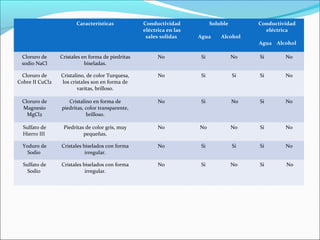
El documento compara la capacidad de las sales para disolverse y conducir electricidad en agua y alcohol. Reporta que las sales tienden a disolverse y conducir mejor en agua que en alcohol debido al carácter polar del agua. Las sales probadas incluyeron NaCl, CuCl2, MgCl2, Fe2(SO4)3, KI, Na2SO4 y KNO3. La mayoría se disolvieron y condujeron electricidad en agua pero no en alcohol.