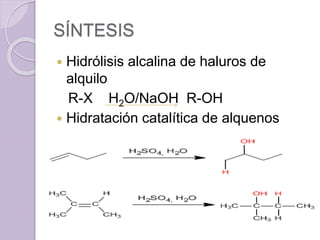
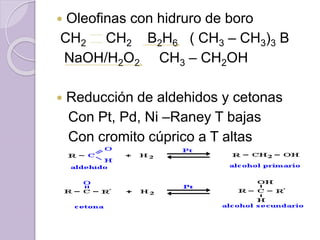
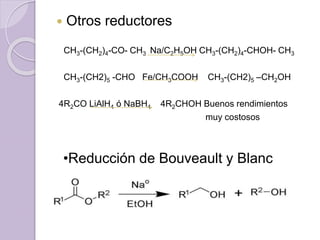
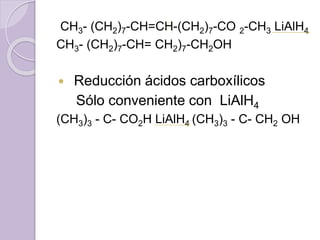
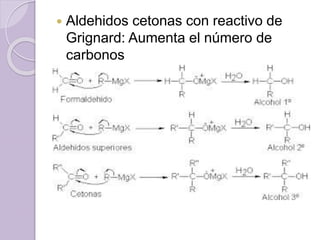
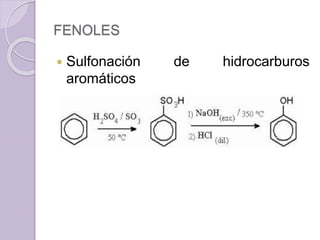
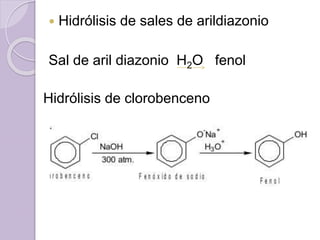
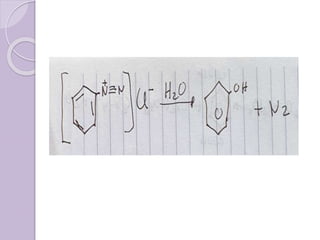
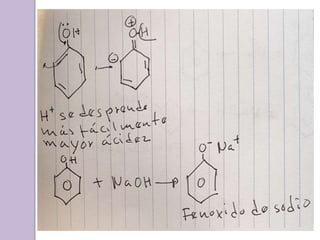
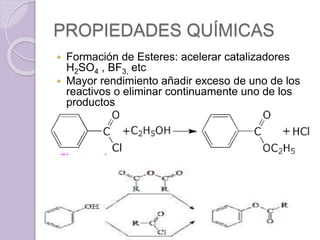
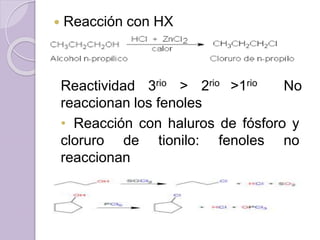
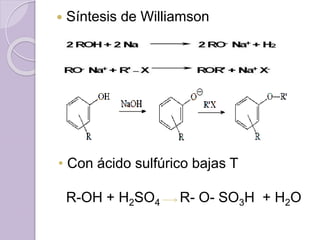
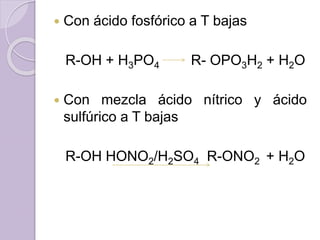
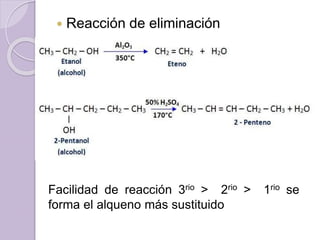
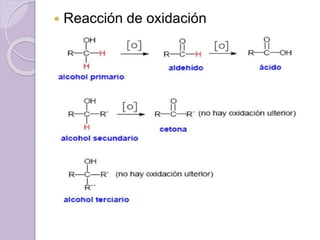
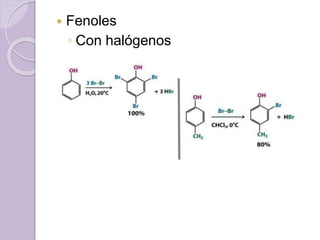
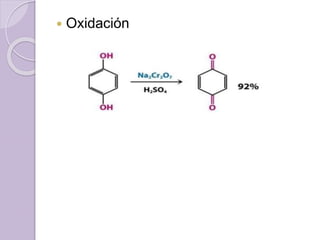
Este documento describe las propiedades y reacciones químicas de los alcoholes y fenoles. Explica que los alcoholes se forman por sustitución de hidrógenos por grupos hidroxilo en hidrocarburos, y que los fenoles contienen un grupo hidroxilo unido a un anillo aromático. También resume las propiedades físicas, métodos de síntesis, acidez, reacciones químicas como formación de ésteres y oxidación, y métodos de identificación de alcoholes y fenoles.