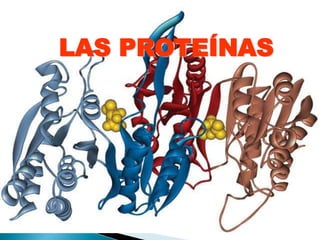
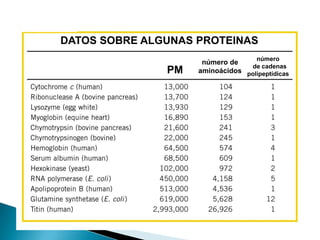
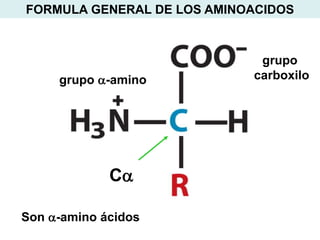
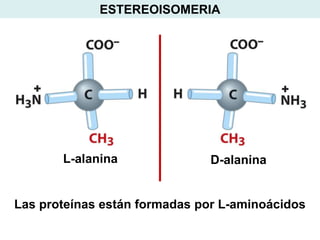
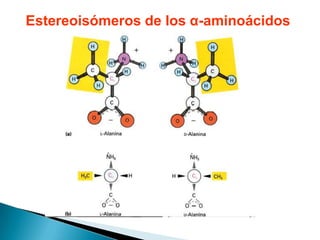
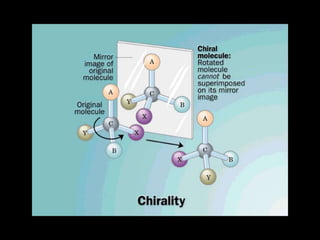
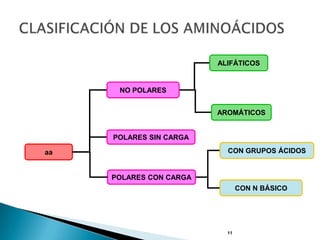
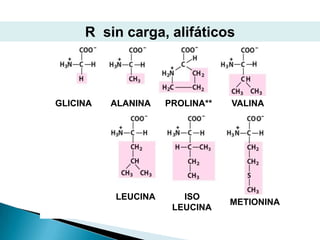
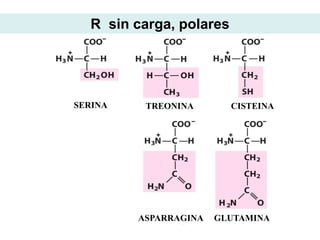
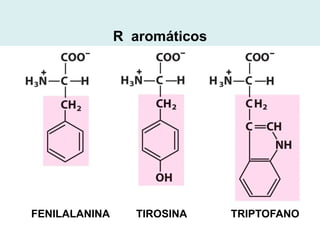
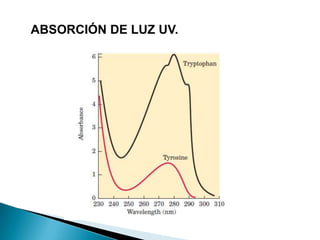
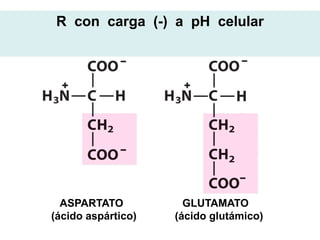
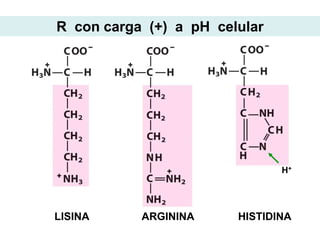
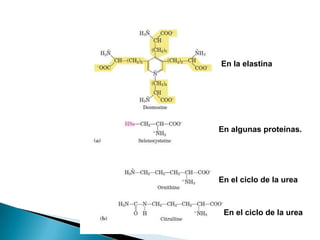
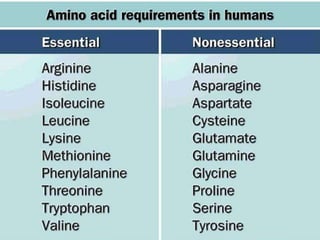
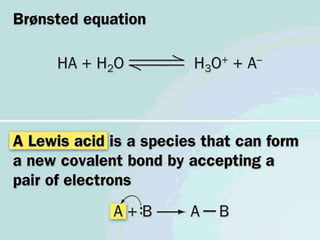
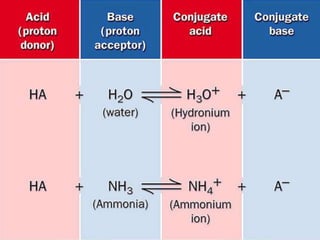
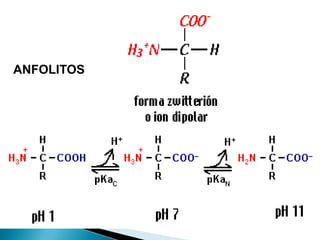
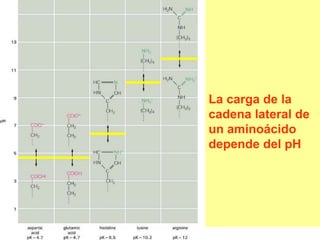
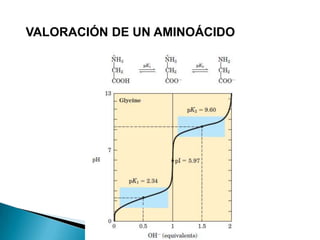
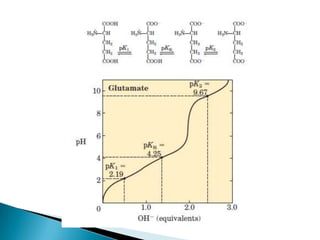
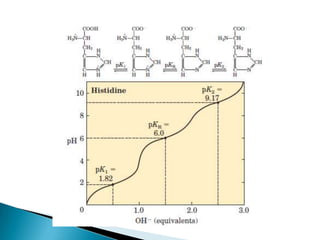
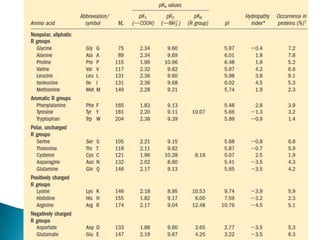
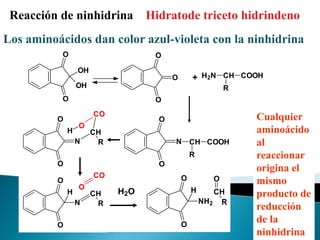
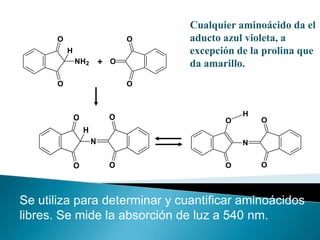
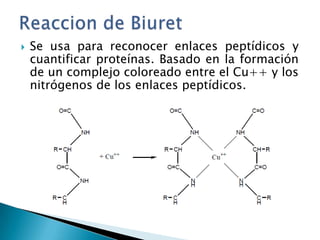
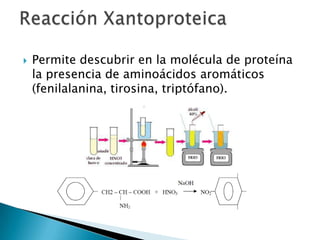
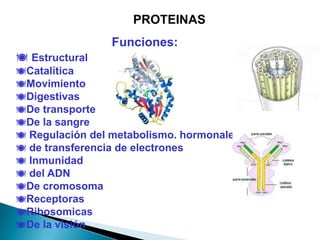
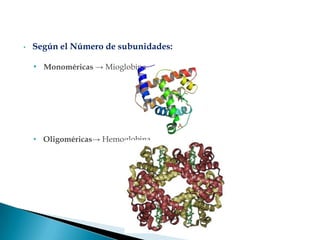
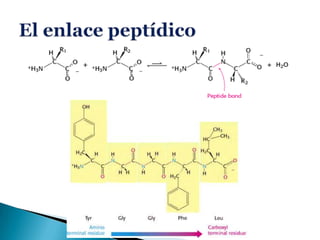
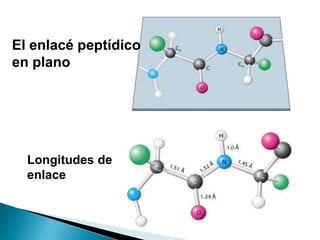
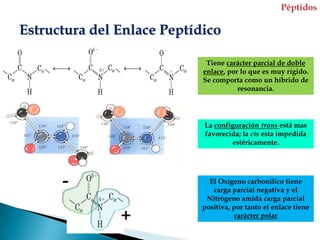
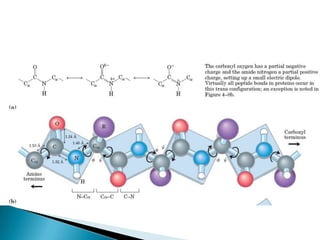
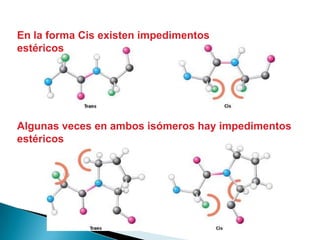
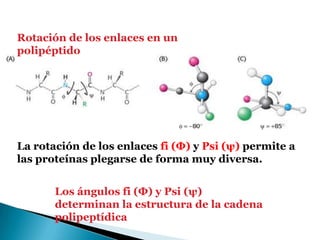
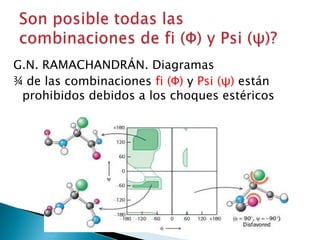
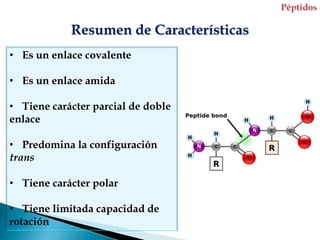
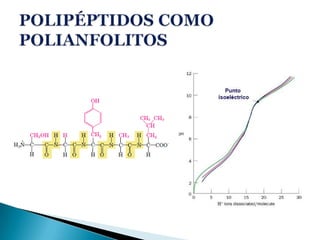
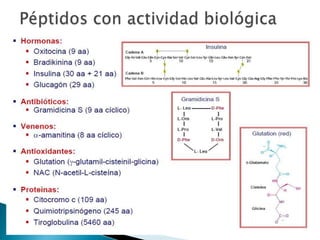
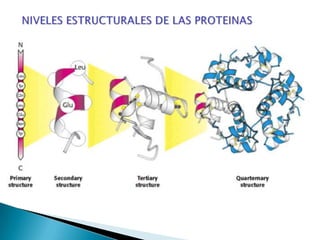
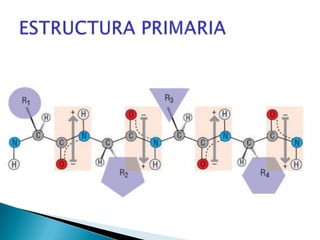
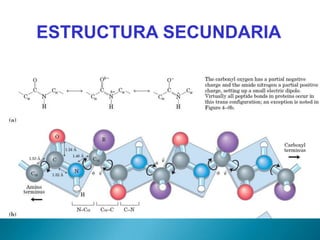
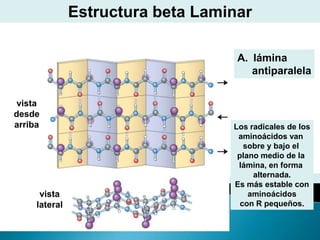
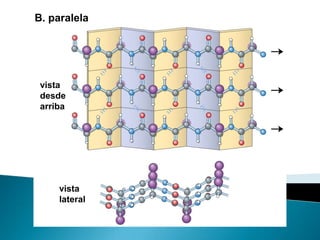
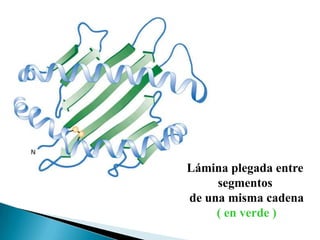
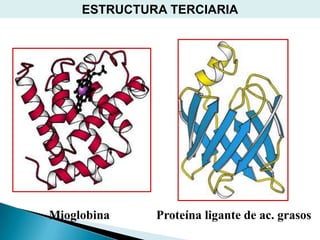
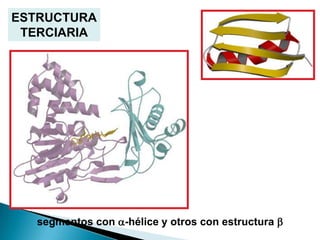
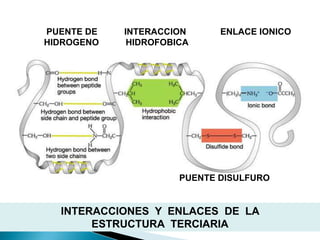
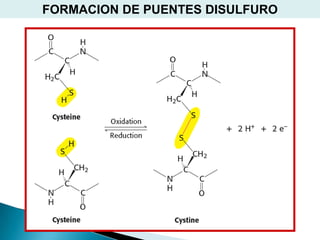
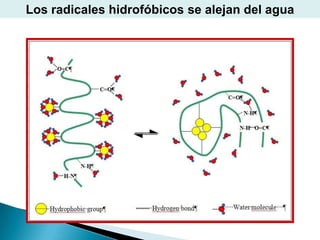
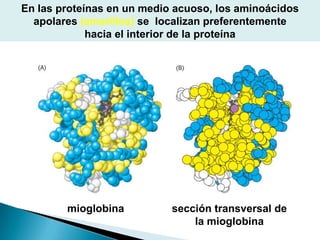
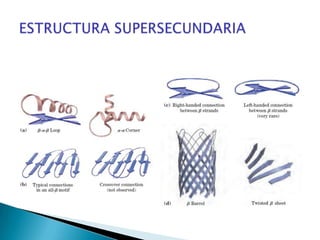
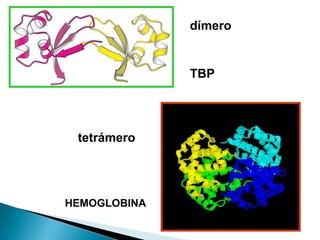
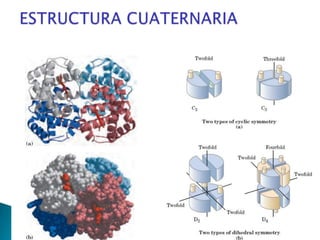
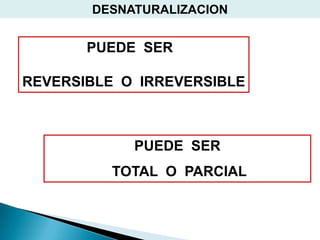
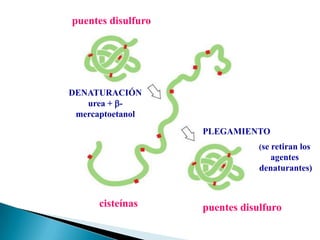
Este documento describe las proteínas y los aminoácidos. Explica que las proteínas están formadas por cadenas de aminoácidos unidos por enlaces peptídicos. Describe las estructuras secundaria, terciaria y cuaternaria de las proteínas y los factores que contribuyen a mantener estas estructuras. También explica los procesos de desnaturalización de proteínas.