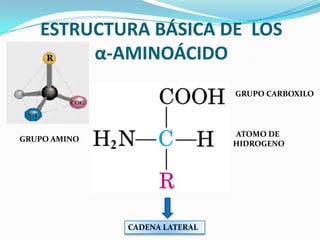
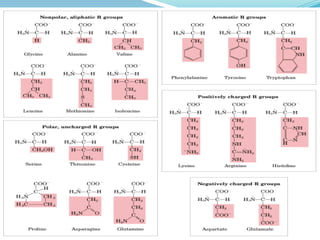
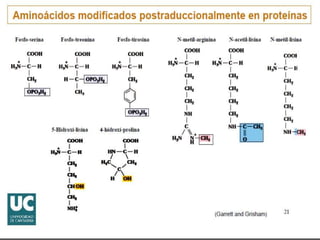
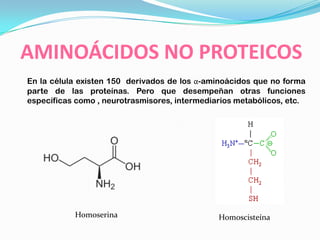
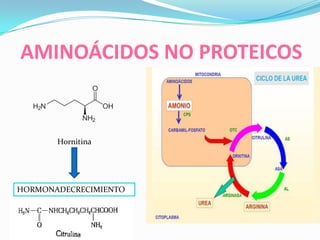
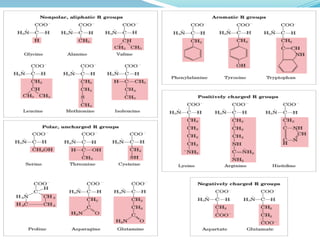
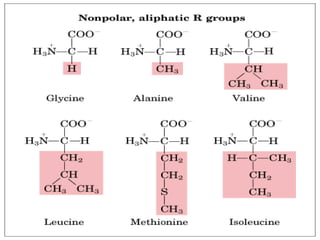
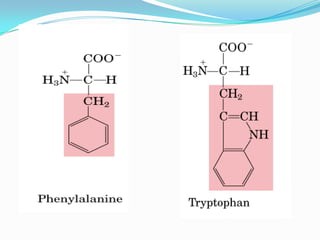
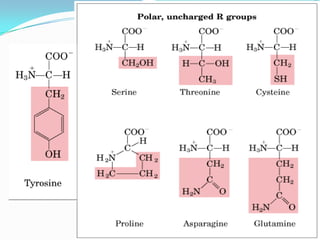
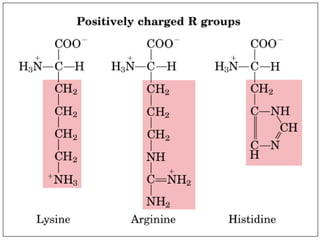
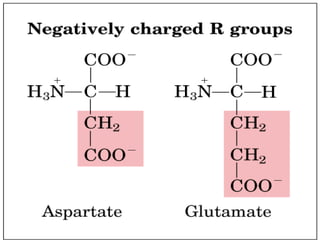
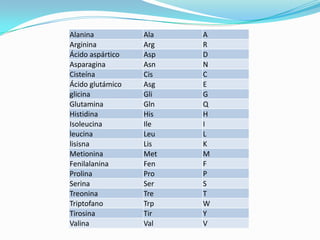
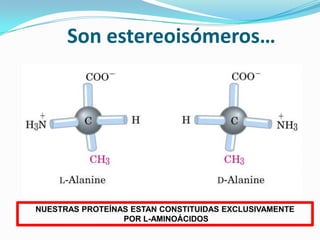
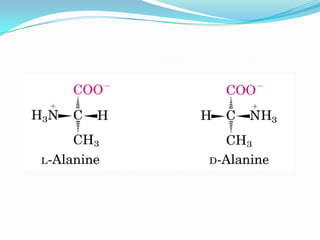
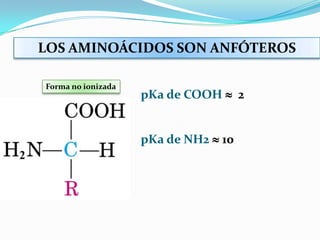
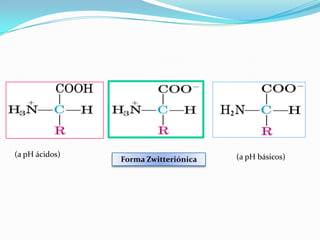
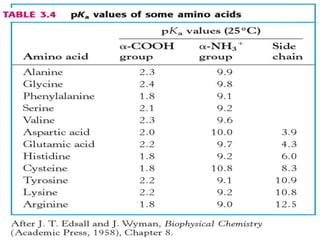
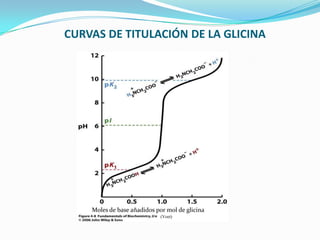
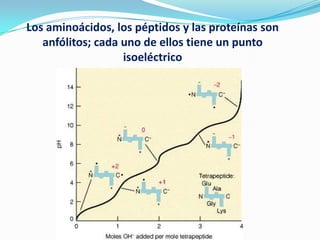
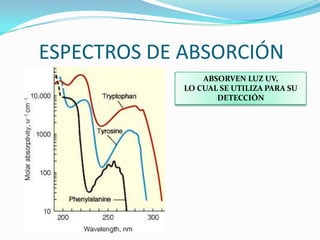
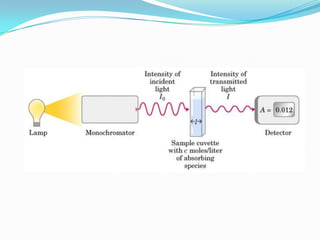
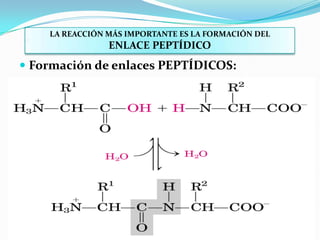
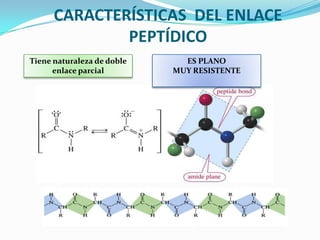
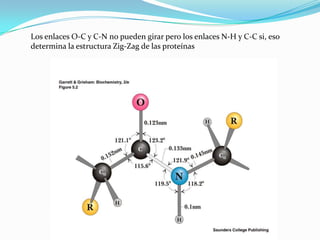
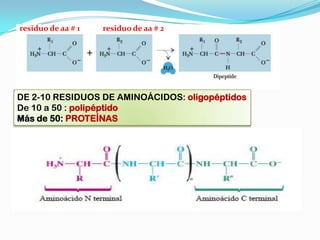
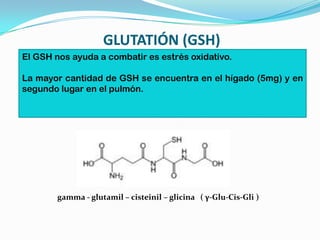
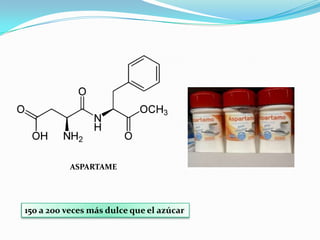
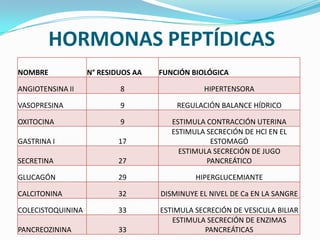
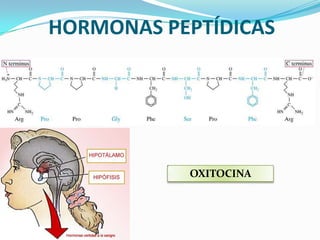
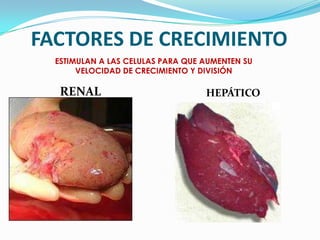
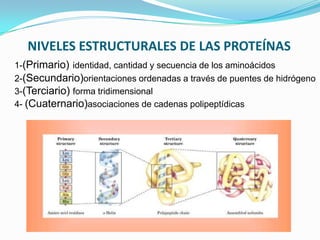
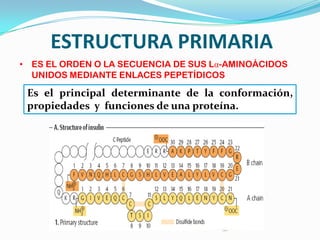
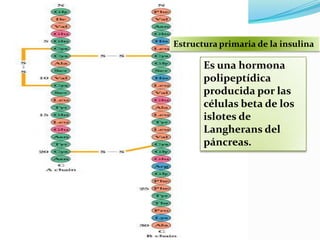
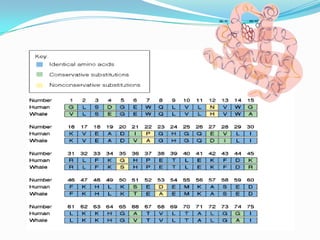
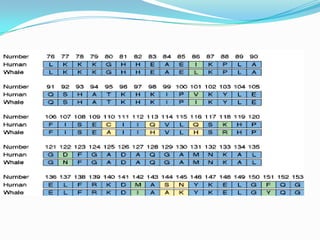
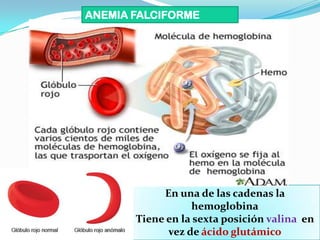
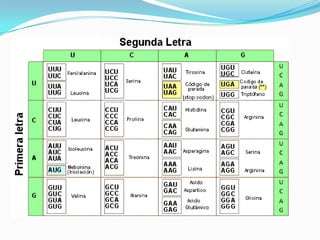
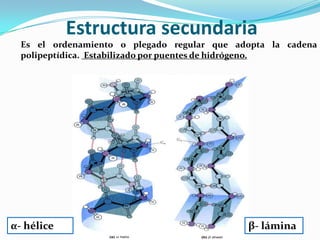
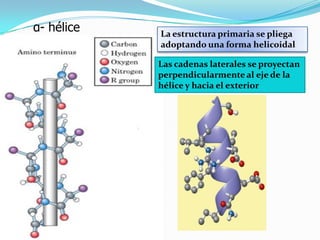
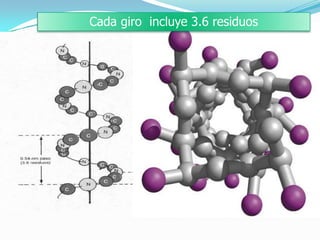
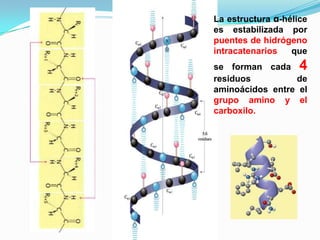
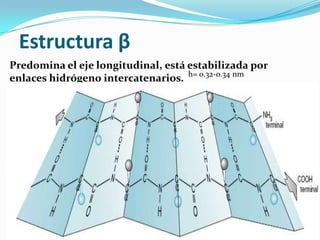
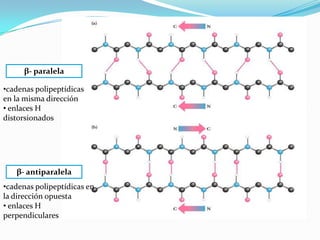
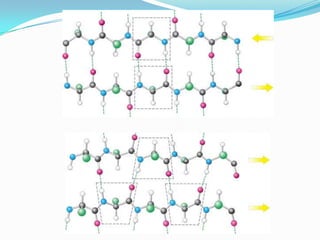
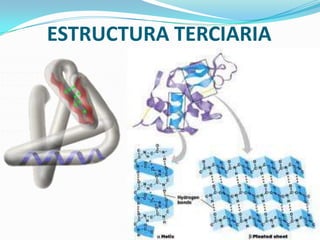
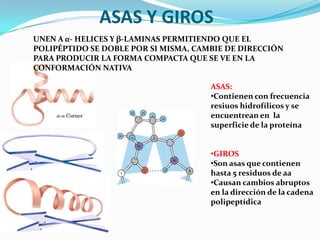
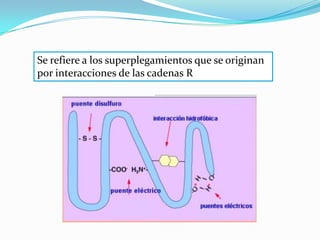
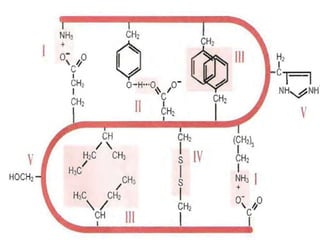
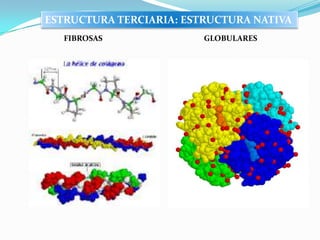
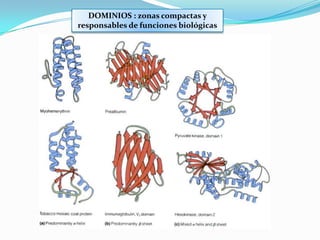
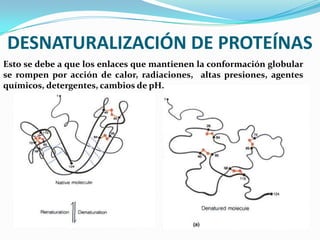
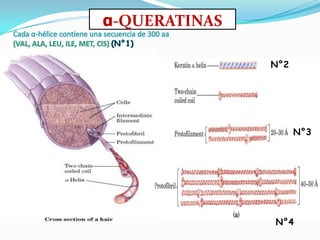
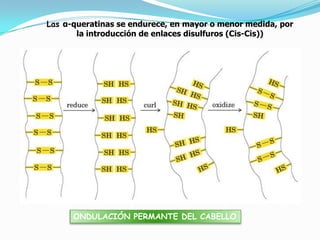
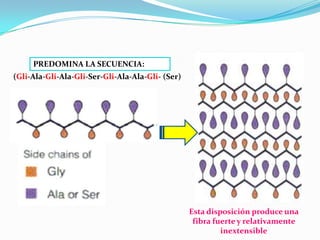
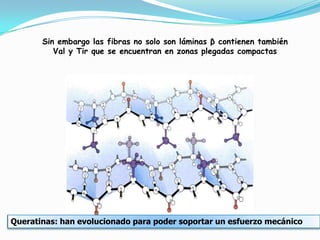
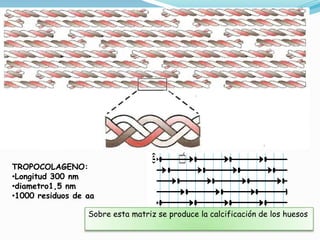
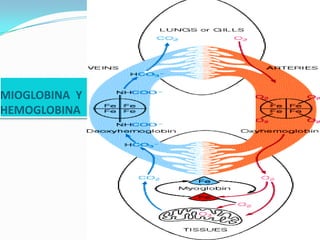
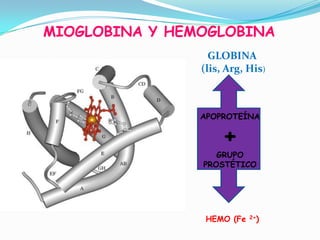
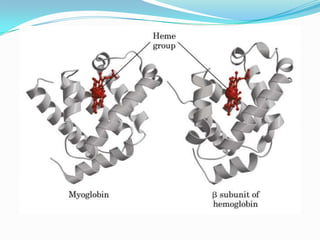
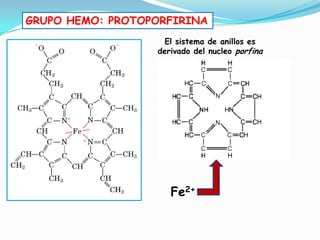
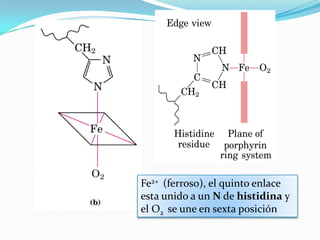
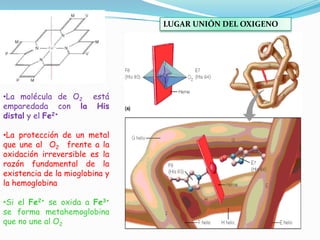
El documento habla sobre aminoácidos y proteínas. Explica la estructura y propiedades de los aminoácidos, los enlaces peptídicos y las diferentes estructuras de las proteínas. También menciona aminoácidos no proteicos, hormonas peptídicas y factores de crecimiento.