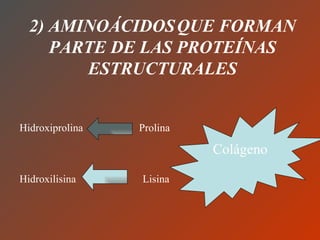
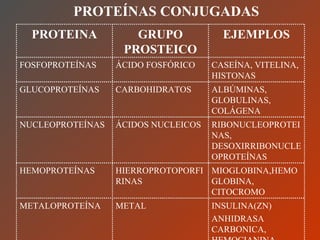
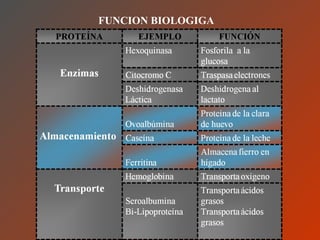
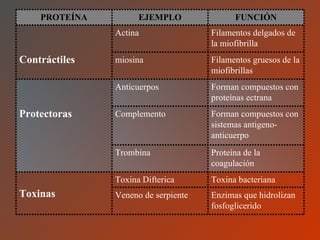
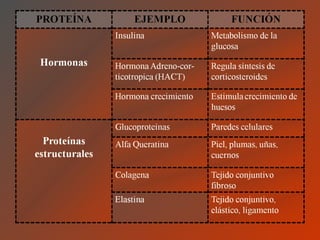
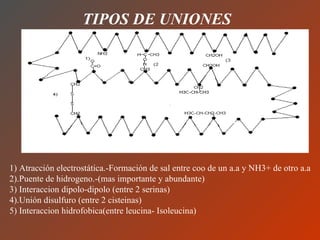
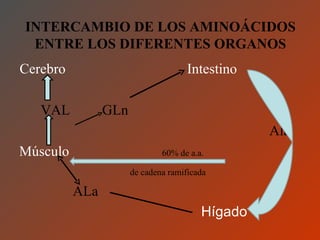
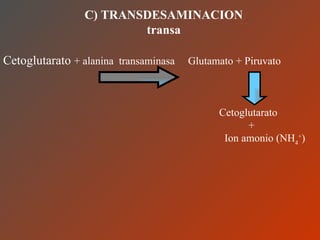
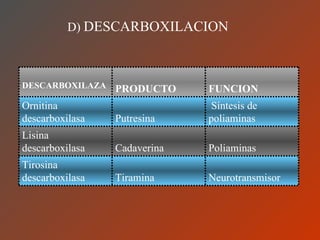
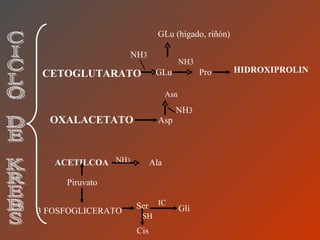
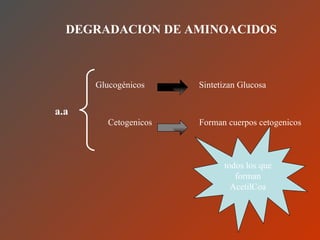
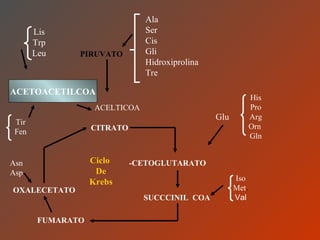
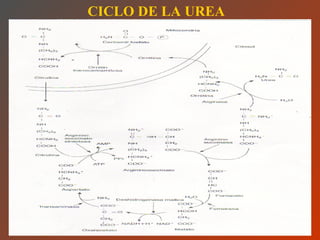
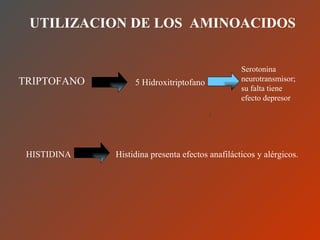
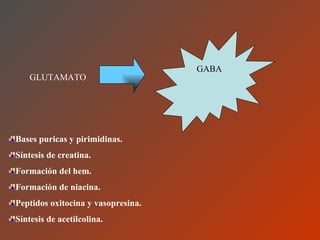
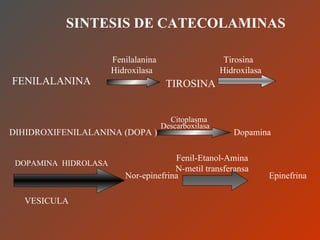
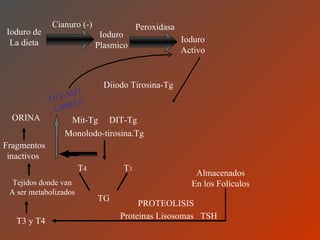
El documento clasifica y describe los aminoácidos. Se dividen en no polares hidrofílicos, polares neutros, ácidos y básicos. Algunos forman parte de proteínas estructurales como el colágeno. Los aminoácidos esenciales son aquellos que el cuerpo no puede sintetizar y deben obtenerse de la dieta. Otros están presentes en el organismo pero no forman parte de proteínas. El documento también describe las proteínas conjugadas, su clasificación, función biológica y los tipos de union