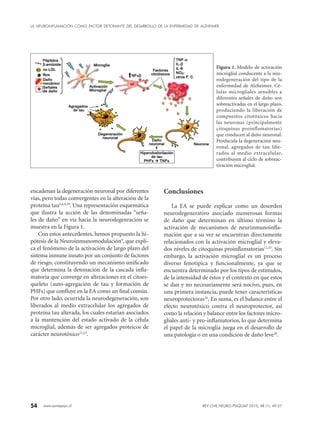
Este documento discute la neuroinflamación como un factor clave en el desarrollo de la enfermedad de Alzheimer. Múltiples factores de daño como estrés oxidativo, metabolismo lipídico y glucídico alterados, traumatismos craneales, e infecciones pueden activar las células gliales y desencadenar una cascada inflamatoria que conduce a la hiperfosforilación y agregación anormal de la proteína tau, formando ovillos neurofibrilares, lo que es un evento clave en la neurodegeneración asoci