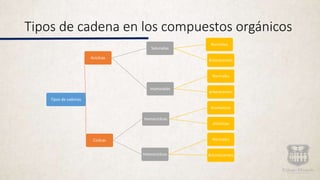
Este documento resume los diferentes tipos de cadenas y fórmulas de compuestos orgánicos, incluidas cadenas acíclicas, ciclicas y aromáticas. También explica los diferentes tipos de carbono, isomería, incluida la estructural, funcional y estereoisomería. La isomería puede ocurrir cuando compuestos tienen la misma fórmula molecular pero diferentes estructuras o orientaciones espaciales de los átomos.