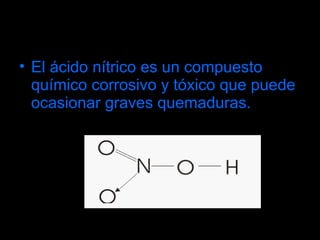
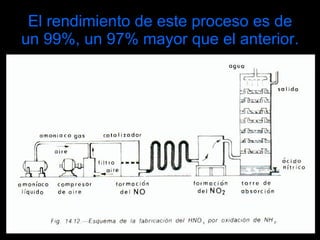
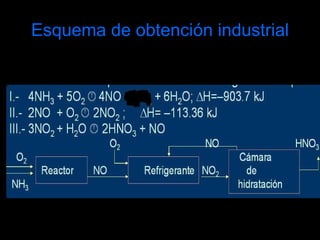
El ácido nítrico es un líquido incoloro, corrosivo y tóxico que se obtiene industrialmente mediante el método de Ostwald, el cual involucra la oxidación del amoníaco con aire y óxido nitroso. Es uno de los ácidos más importantes industrialmente y se utiliza ampliamente en la fabricación de abonos, explosivos, colorantes y otros productos químicos.