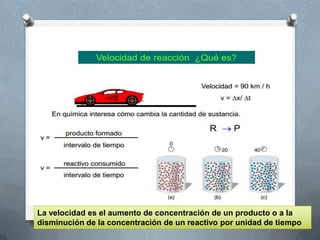
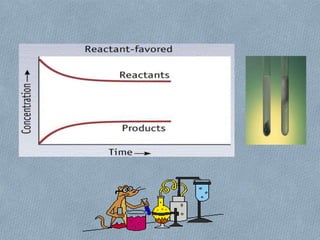
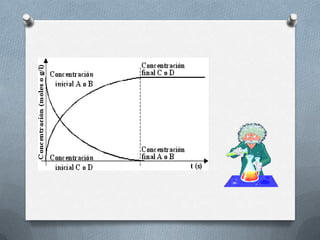
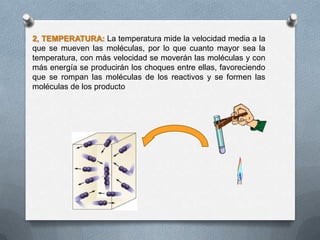
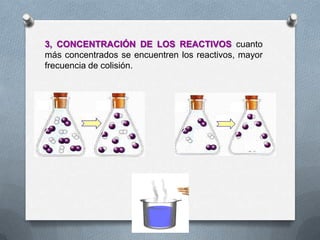
La cinética estudia la velocidad de las reacciones químicas y los factores que afectan dicha velocidad, como la naturaleza de los reactivos, la temperatura, la concentración de los reactivos y la presencia de catalizadores. La velocidad de una reacción depende de la frecuencia de colisión entre las moléculas de los reactivos, la cual aumenta con la temperatura, la concentración y la presión del sistema. Los catalizadores aceleran las reacciones sin formar parte de los productos finales.