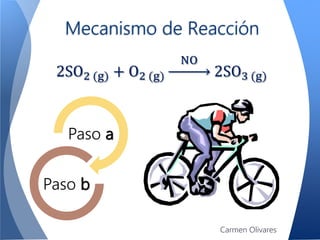
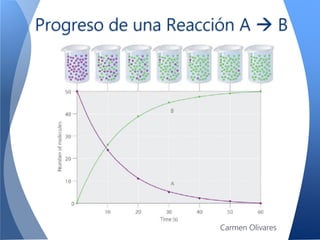
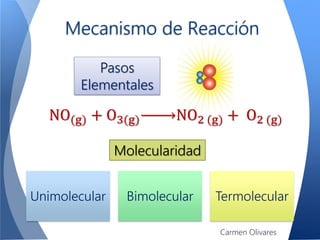
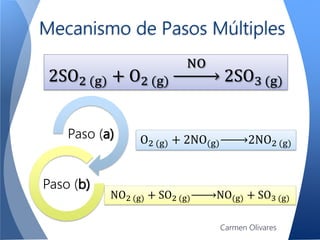
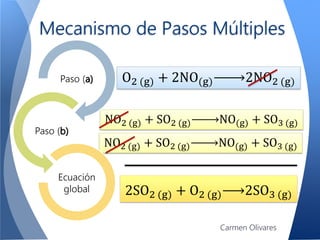
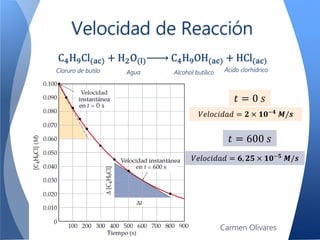
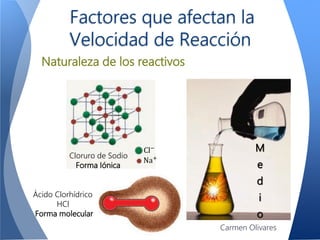
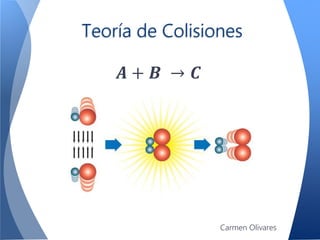
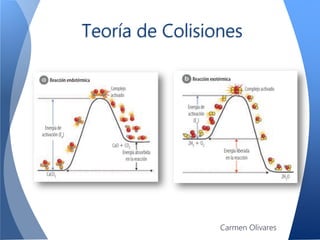
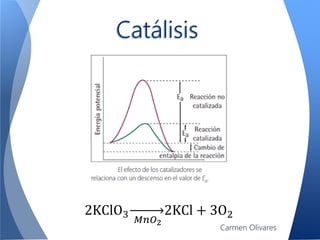
El documento aborda la cinética química, definiéndola y explicando su importancia en las reacciones químicas. Se discuten los mecanismos de reacción, la velocidad de reacción y los factores que la afectan, así como la teoría de colisiones y el efecto de la temperatura y la concentración. También se menciona el papel de los catalizadores y las enzimas en las reacciones químicas.