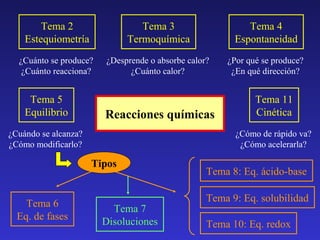
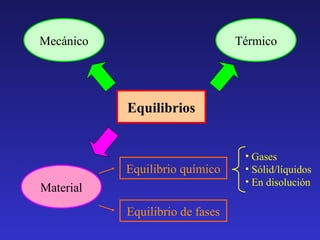
El documento presenta un resumen de 11 temas relacionados con la química de equilibrios. Los temas incluyen equilibrio químico, termoquímica, espontaneidad de reacciones, cinética química, equilibrios de fases, disoluciones, equilibrios ácido-base, equilibrios de solubilidad y redox. Cada tema presenta conceptos clave y ejemplos relevantes.


![1
ASPECTOS BÁSICOS DEL EQUILIBRIO
QUÍMICO.
Estado de equilibrio: estado en que la composición
del sistema permanece fija.
1.1. Perspectiva cualitativa.
• Equilibrio dinámico.
• Los sistemas evolucionan espontáneamente hacia un
estado de equilibrio.
• Las propiedades del estado de equilibrio son las mismas,
independientemente de la dirección desde la que se alcanza.
1.2. Perspectiva cuantitativa.
Ley de acción de masas
aA + bB ↔ cC + dD
[ C] c [ D ] d
[ A] a [ B] b
= constante](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-5-320.jpg)
![2
CONDICIÓN GENERAL DEL
EQUILIBRIO QUÍMICO.
A P y T constantes, el sentido del cambio espontáneo es el sentido
de la disminución de G.
Proceso espontáneo: ∆G < 0
[Tema 4]
∆G = ∑ G(prod) − ∑ G (reac)
prod
Inicio: ∆G < 0
reac
∑ G(prod) < ∑ G (reac)
prod
reac
Equilibrio: ∆ G = 0
∑ G(prod) = ∑ G (reac)
prod
reac
[Tema 4]](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-6-320.jpg)
![3
EQUILIBRIO QUÍMICO EN SISTEMAS
GASEOSOS IDEALES.
EQUILIBRIO HOMOGÉNEO
∆G = ∑ G(prod) − ∑ G (reac) = cG C + dG D − aG A − bG B
prod
reac
Pi
Para una mezcla de gases ideales: G i = G + RT ln
Pº
o
i
o
o
o
o
∆G = cG C + dG D − aG A − bG B + cRT ln
c
[Levine, pg 175-177]
PC
P
P
P
+ dRT ln D − aRT ln A − bRT ln B
Pº
Pº
Pº
Pº
d
PC PD
Pº Pº
∆G = ∆Gº + RT ln
a
b
PA PB
Pº Pº
Q : Cociente de reacción
∆G = ∆Gº + RT ln Q
Isoterma de reacción](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-7-320.jpg)



![Otras expresiones de la constante de equilibrio
PC c PD d
( PC ) c ( PD ) d
Pº Pº
Ko =
=
p
a
b
a
b
PA PB
( PA ) ( PB ) eq
Pº Pº eq
(dimensional)
[ C] c [ D] d
Kc =
a
b
[ A ] [ B]
Si ∆n = 0
d
1 1
Pº Pº
a
b
1 1
Pº Pº
Kp
En función de las concentraciones:
c
(Pº)-∆n
[Petrucci, pg 635]
Kp = Kc (RT)∆n
Kpº = Kp = Kc](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-11-320.jpg)
![4
EQUILIBRIOS HETEROGÉNEOS.
Aquéllos en los que las sustancias están en fases distintas
p.ej.: CaCO3 (s) ↔ CaO (s) + CO2 (g)
La situación de equilibrio no se ve afectada por la cantidad de
sólido o líquido, siempre y cuando estas sustancias estén presentes.
La constante de equilibrio es independiente de las cantidades
de sólidos y líquidos en el equilibrio.
CaCO3 (s) ↔ CaO (s) + CO2 (g)
Kc = [CO2]](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-12-320.jpg)

![1901
Primer premio Nobel
de Química
“En reconocimiento a los extraodinarios servicios que ha
prestado con el descubrimiento de las leyes de la dinámica
química y la presión osmótica en disoluciones”.
Jacobus Henricus van’t Hoff
(1852-1911)
[http://www.nobel.se/chemistry/laureates/1901/index.html]
d ln K o
p
dT
∆H º
=
RT 2
K o ( T2 )
p
∫K o ( T1 )
p
∆H º
d ln K = ∫
dT
2
RT
K o (T2 )
p
o
p
T2
T1
∆H º 1 1
Ecuación integrada ln
−
=
o
K p (T1 )
R T1 T2
de van’t Hoff
Si
∆Hº = cte](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-14-320.jpg)





![6.1. Efecto de un cambio de temperatura (a P cte)
• Si ∆Hº > 0 (endotérmica): T ↑ ⇒ se desplazará a la derecha
• Si ∆Hº < 0 (exotérmica):
T ↑ ⇒ se desplazará a la izquierda
6.2. Efecto de la adicción/sustracción de moles de
reactivos o productos gaseosos (a T y V ctes)
Kc =
[prod]eq
[reac]eq
[prod]
; Q=
[reac]
• Si agrego productos: Q > Kc ⇒ se desplazará a la izquierda
• Si agrego reactivos: Q < Kc ⇒ se desplazará a la derecha](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-20-320.jpg)

![6.5. Adición de un gas inerte (a T y V ctes)
No altera el equilibrio
[prod] n prod / V
=
[reac] n reac / V
6.6. Adición de un catalizador
No afecta al equilibrio
6.7. Adición de un reactivo/producto sólido o líquido
No altera el equilibrio](https://image.slidesharecdn.com/equilibrioquimico-131211080029-phpapp01/85/Equilibrio-quimico-22-320.jpg)