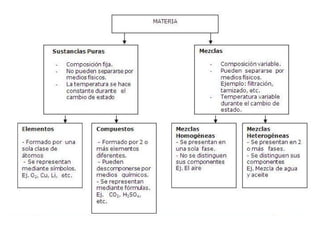
Este documento presenta una introducción a la química como ciencia que estudia la materia, sus propiedades y transformaciones. Explica conceptos fundamentales como materia, masa, peso, energía y diferentes tipos de cambios y sistemas materiales. También resume las principales ramas de la química y termina definiendo propiedades de la materia y diferenciando cambios físicos de cambios químicos.