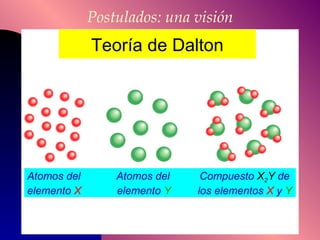
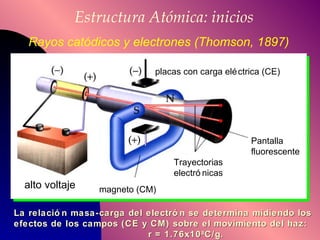
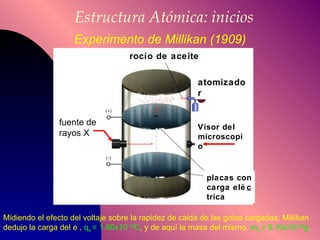
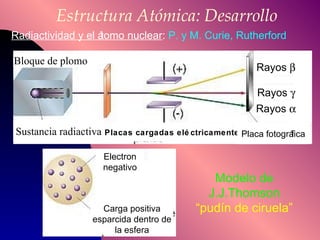
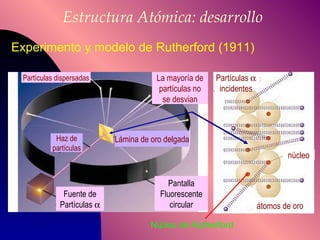
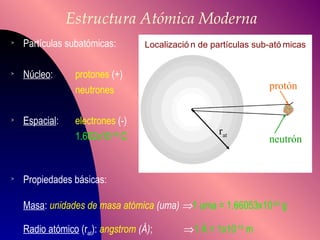
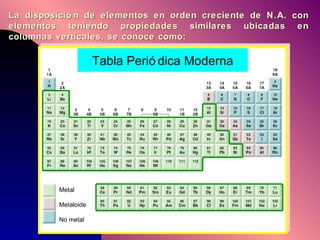
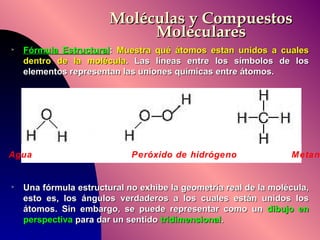
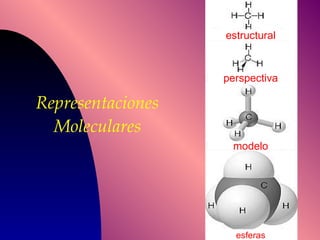
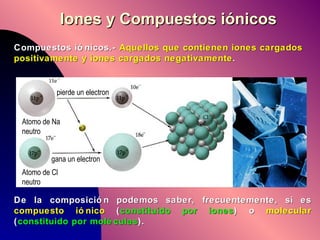
El documento describe la historia y desarrollo de la teoría atómica desde los filósofos griegos hasta el modelo atómico moderno, incluyendo los postulados de Dalton, las evidencias experimentales de Thomson, Rutherford y otros, y la estructura del átomo con protones, neutrones y electrones. También explica conceptos como moléculas, iones, la tabla periódica y sus propiedades periódicas.