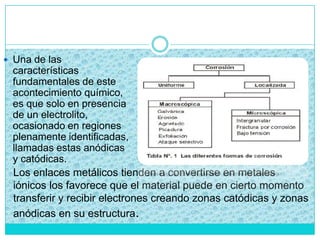
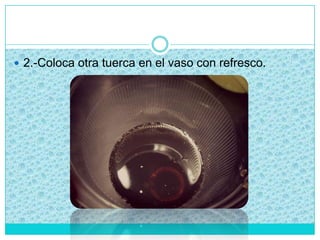
Este documento presenta un proyecto sobre cómo evitar la corrosión. Explica qué es la corrosión, los objetivos de investigar este tema, una hipótesis sobre por qué ocurre la corrosión en los metales, y una introducción al tema. Luego describe experimentos realizados y conclusiones sobre cómo la corrosión puede desoxidarse usando vinagre, jugo de limón o refresco negro. El documento incluye también un crucigrama y una autoevaluación del proyecto.