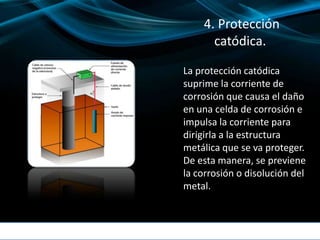
El documento describe los diferentes tipos y causas de la corrosión, así como los métodos para prevenirla y controlarla. Explica que la corrosión es una reacción electroquímica entre un metal y su ambiente que deteriora el material. Luego detalla los cinco métodos primarios para controlar la corrosión: selección de materiales, recubrimientos, inhibidores, protección catódica y diseño. Finalmente, brinda ejemplos de cómo la corrosión puede afectar objetos cotidianos.