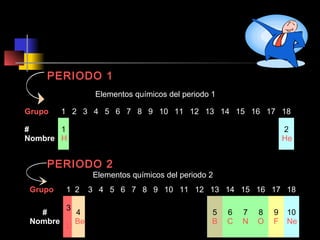
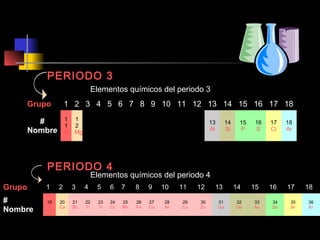
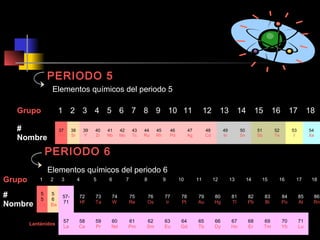
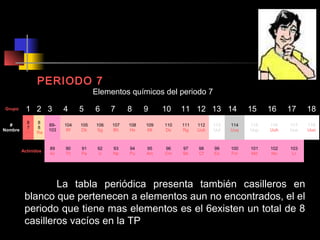
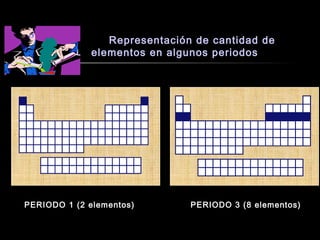
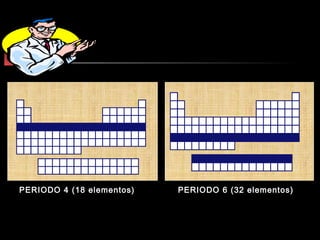
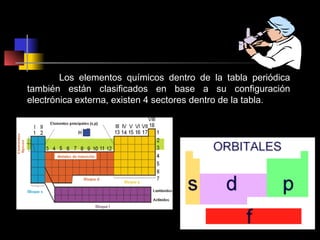
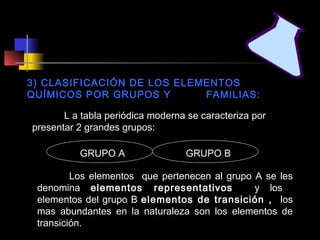
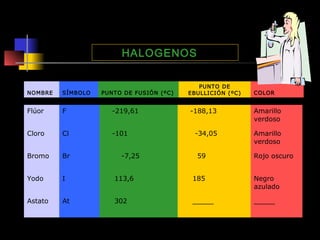
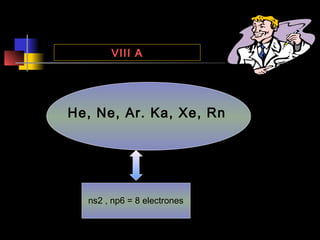
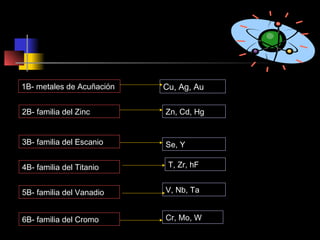
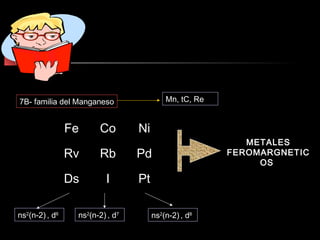
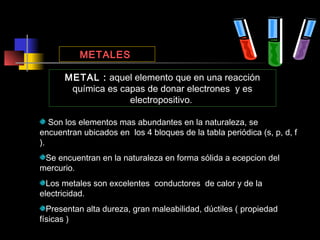
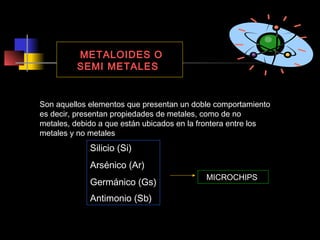
El documento proporciona información sobre la configuración electrónica de los elementos químicos y la tabla periódica. Explica las reglas del principio de Aufbau para establecer la configuración electrónica, así como conceptos como los periodos, familias y grupos en la tabla periódica. También presenta ejemplos de configuraciones electrónicas de elementos y problemas sobre este tema.