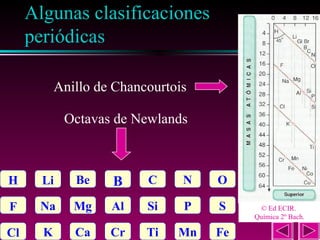
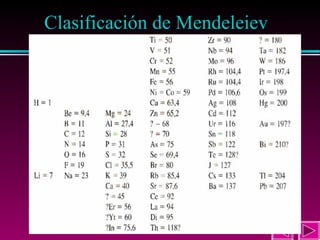
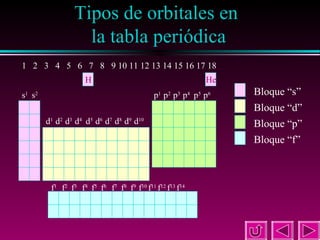
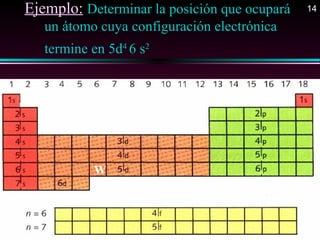
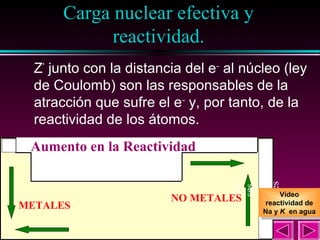
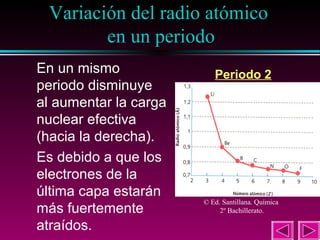
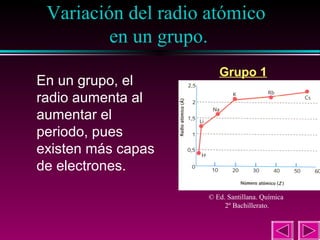
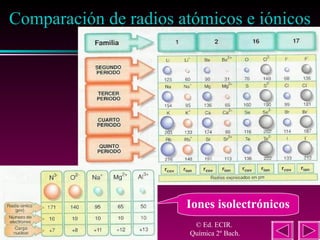
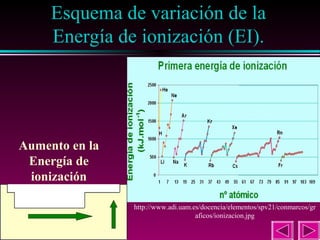
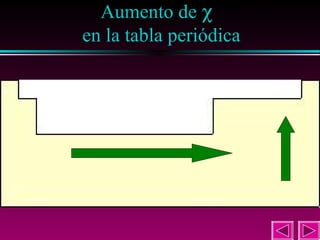
Este documento describe las primeras clasificaciones periódicas de los elementos químicos, incluyendo la clasificación de Mendeleiev de 1863 que predijo las propiedades de elementos aún no descubiertos. También describe la tabla periódica actual basada en el número atómico introducido por Moseley en 1913 y las variaciones periódicas de propiedades como el tamaño atómico, energía de ionización, afinidad electrónica y electronegatividad.