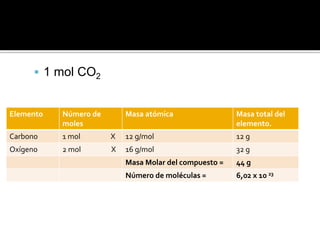
El documento explica el concepto de mol y cómo se usa para medir la masa de sustancias y elementos químicos. Un mol representa 6.022x1023 átomos, moléculas o iones de un elemento o compuesto. La masa molar de un elemento o compuesto es la masa en gramos de 1 mol de ese elemento o compuesto.