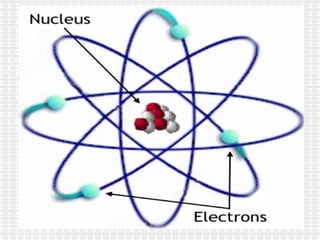
El documento habla sobre los átomos. Explica que un átomo neutro tiene la misma cantidad de protones y electrones y que el número atómico identifica al elemento y es igual al número de protones. También menciona algunos ejemplos de números atómicos e isótopos, que son átomos del mismo elemento con diferentes números de neutrones. Finalmente, detalla cómo calcular la masa atómica de un elemento a partir de la abundancia y masa de sus isótopos.