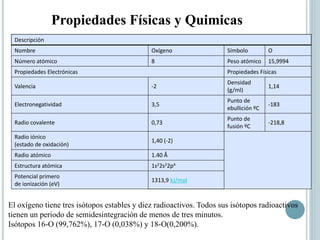
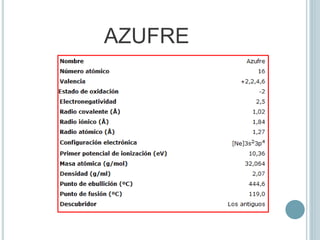
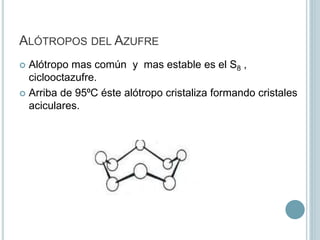
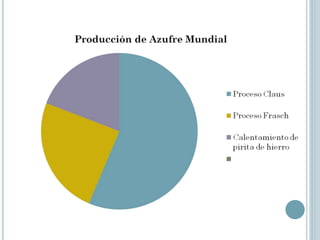
Este documento proporciona información sobre el oxígeno, azufre y selenio, que son elementos del grupo 16. Describe sus propiedades físicas y químicas, formas de obtención, alótropos, compuestos y aplicaciones. Se explica que el oxígeno es un gas esencial para la vida y constituye una gran parte de la atmósfera y la hidrosfera. El azufre tiene varios alótropos como el ciclooctazufre y se obtiene principalmente a través del proceso Frasch. Forma























![ PROPIEDADES FÍSICAS Y QUÍMICAS
Símbolo Se
Número Atómico 34
Masa Atómica 78,96
Estructura electrónica [Ar] 3d10 4s2 4p4
Números de oxidación -2, +4, +6
Electronegatividad 2,55
Energía de ionización (kJ.mol-1) 941
Afinidad electrónica (kJ.mol-1) 195
Radio atómico (pm) 119
Radio iónico (pm) (carga del
ion)
198(-2), 69(+4)
Entalpía de fusión (kJ.mol-1) 5,1
Entalpía de vaporización
(kJ.mol-1)
26,32
Punto de Fusión (ºC) 221
Punto de Ebullición (ºC) 685
Densidad (kg/m3) 4792 (gris); (20
ºC)
Volumen atómico (cm3/mol) 16,48
Estructura cristalina Hexagonal
Color Gris.](https://image.slidesharecdn.com/elementosdelgrupo-16-240202005456-b84313c4/85/ELEMENTOS-DEL-GRUPO-16-ppt-29-320.jpg)













