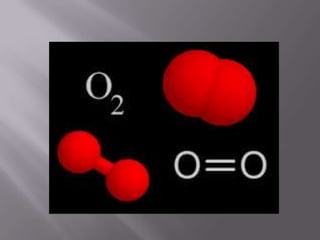
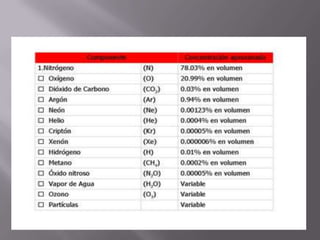
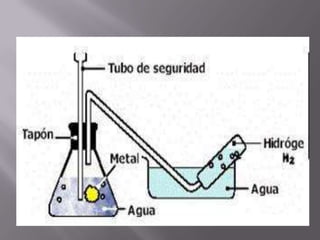
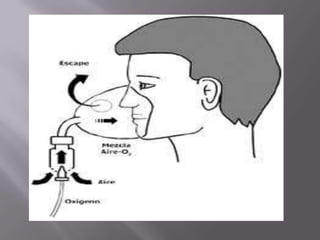
El oxígeno es un elemento químico esencial, con número atómico 8 y símbolo O, fundamental para la vida terrestre, ya que compone un 21% del aire y el 89% del agua. Su descubrimiento se atribuye a Joseph Priestley y su posterior estudio a Antoine Lavoisier, quien demostró su papel en combustiones y respiración. Se obtiene por métodos como la descomposición de compuestos y la destilación de aire, y se emplea en diversas aplicaciones industriales y medicinales.