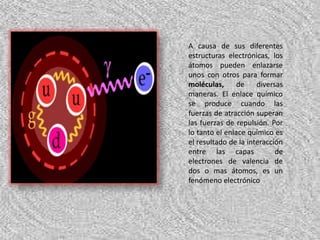
Los átomos pueden unirse mediante enlaces iónicos o covalentes. Los enlaces iónicos se forman por la transferencia de electrones entre átomos, mientras que los enlaces covalentes se forman por el compartir de electrones entre átomos. La teoría del enlace de valencia explica que los enlaces covalentes se producen por la superposición de los orbitales atómicos, mientras que la teoría orbital molecular establece que al formarse las moléculas, los orbitales atómicos desaparecen y se forman nue