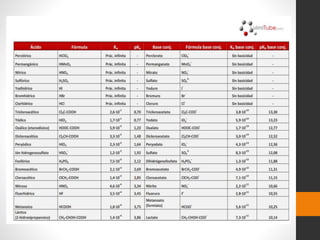
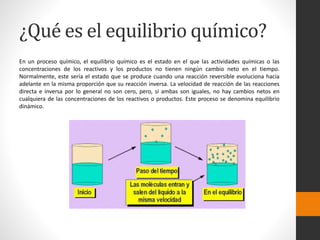
El documento trata sobre el equilibrio químico. Explica que el equilibrio químico ocurre cuando las velocidades de las reacciones directa e inversa son iguales, de modo que no hay cambios netos en las concentraciones. También describe cómo se expresa matemáticamente la constante de equilibrio y cómo depende de factores como la temperatura. Además, analiza conceptos como la energía de activación, ionización, disociación y los diferentes tipos de enlaces.

![¿Cómo se expresa la constante de
equilibrio?
En el temperatura. A la relación que hay entre estas concentraciones, expresadas en molaridad
[mol/L], se le llama constante de equilibrio. El valor de la constante de equilibrio depende de la
temperatura equilibrio las concentraciones de reactivos y productos permanecen constantes en
determinadas condiciones de presión y del sistema, por lo que siempre tiene que especificarse.
Así, para una reacción reversible, se puede generalizar:
aA + bB cC + dD
[C]c [D]d
Keq = ▬▬▬▬
[A]a [B]b
En esta ecuación Keq es la constante de equilibrio para la reacción a una temperatura dada. Ésta
es una expresión matemática de la ley de acción de masas que establece: para una reacción
reversible en equilibrio y a una temperatura constante, una relación determinada de
concentraciones de reactivos y productos tiene un valor constante Keq.
En el equilibrio, las concentraciones de los reactivos y productos pueden variar, pero el valor de
Keq permanece constante si la temperatura no cambia.](https://image.slidesharecdn.com/equilibrioquimico1-141117145532-conversion-gate01/85/Equilibrio-quimico-1-3-320.jpg)
![De esta manera, el valor de la constante de equilibrio a una cierta temperatura nos sirve para predecir
el sentido en el que se favorece una reacción, hacia los reactivos o hacia los productos, por tratarse de
una reacción reversible.
Un valor de Keq > 1, indica que el numerador de la ecuación es mayor que el denominador, lo que
quiere decir que la concentración de productos es más grande, por lo tanto la reacción se favorece
hacia la formación de productos. Por el contrario, un valor de Keq < 1, el denominador es mayor que el
numerador, la concentración de reactivos es más grande, así, la reacción se favorece hacia los reactivos.
Conocer el valor de las constantes de equilibrio es muy importante en la industria, ya que a partir de
ellas se pueden establecer las condiciones óptimas para un proceso determinado y obtener con la
mayor eficiencia el producto de interés.
Cuando todos los reactivos y productos están en disolución, la constante de equilibrio se expresa en
concentración molar [moles/L]. Si se encuentran en fase gaseosa es más conveniente utilizar presiones
parciales (P). Los sólidos y los líquidos puros no intervienen en la constante, por considerar que su
concentración permanece constante. Generalmente al valor de la constante no se le ponen unidades.
[C]c [D]d
Keq = Kc = ▬▬▬▬
[A]a [B]b
(Pc)c (Pd)d
Keq = Kp = ▬▬▬▬
(Pa)a (Pb)b](https://image.slidesharecdn.com/equilibrioquimico1-141117145532-conversion-gate01/85/Equilibrio-quimico-1-4-320.jpg)