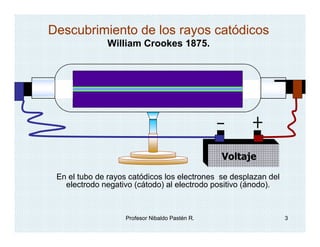
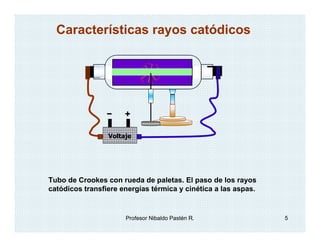
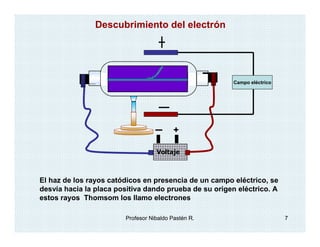
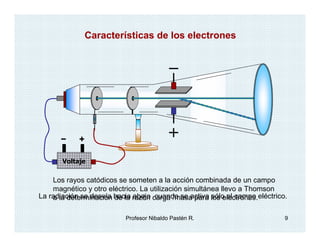
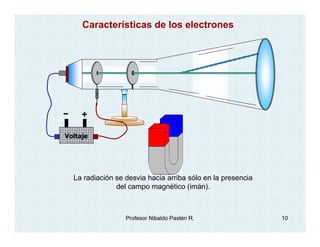
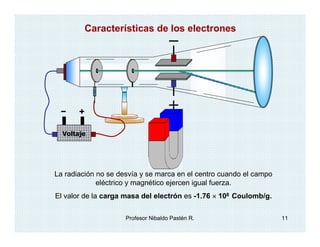
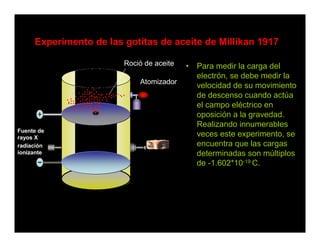
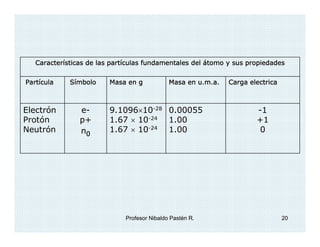
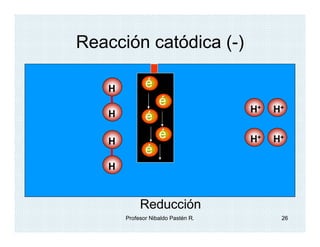
El documento describe el descubrimiento y caracterización de las partículas subatómicas fundamentales como el electrón, protón y neutrón. John Dalton propuso la teoría atómica en 1806. Más tarde, los experimentos con tubos de rayos catódicos llevaron al descubrimiento del electrón y la determinación de su carga y masa. Otros experimentos identificaron al protón y su carga positiva igual pero opuesta a la del electrón. Finalmente, Chadwick descubrió el neutrón en 1932 como una partícula sin c