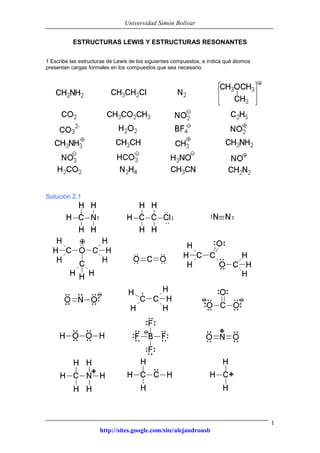
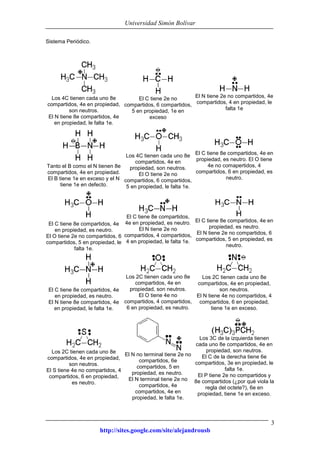
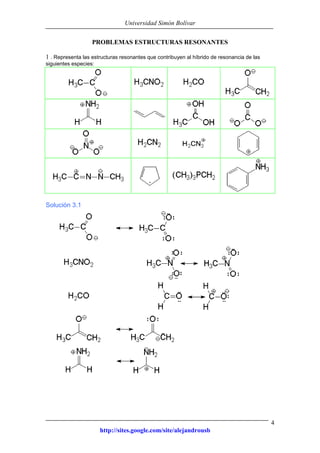
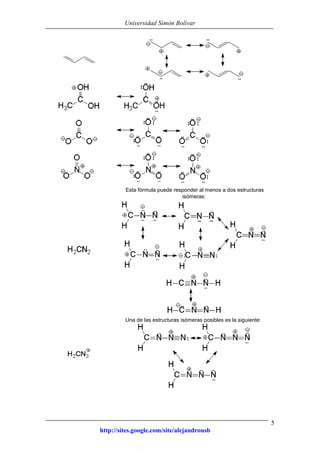
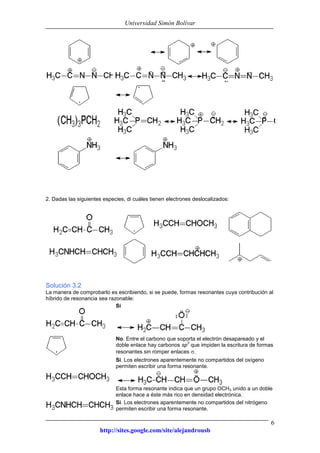
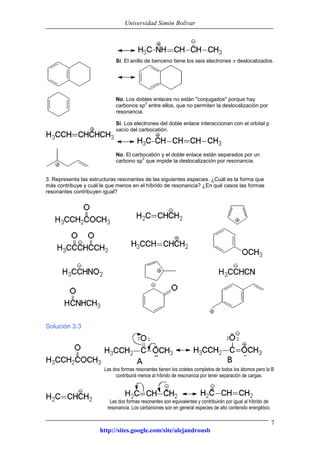
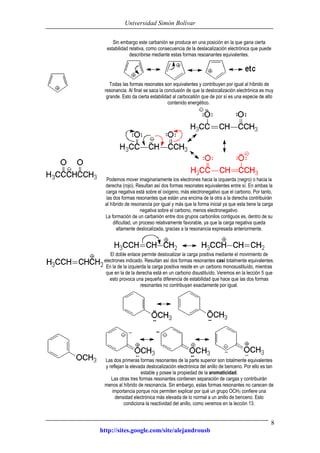
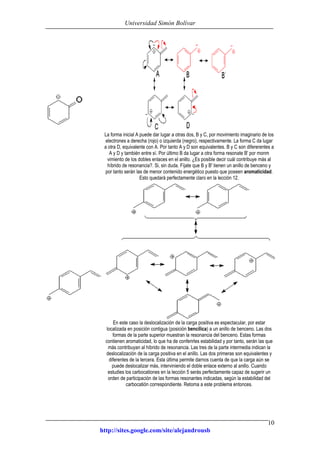
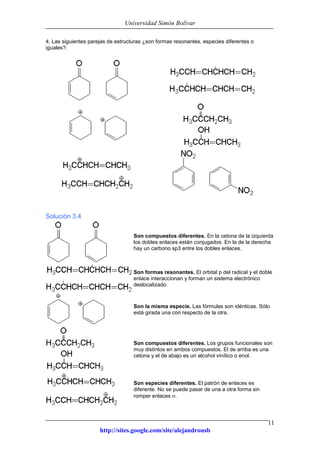
Este documento presenta información sobre estructuras de Lewis y estructuras resonantes. Explica cómo determinar las cargas formales en diferentes compuestos químicos mediante el conteo de electrones. También muestra ejemplos de estructuras resonantes y discute cómo la resonancia contribuye a la estabilidad de los compuestos. Finalmente, proporciona problemas y soluciones sobre estructuras resonantes.