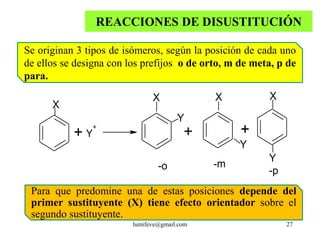
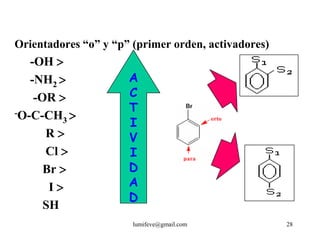
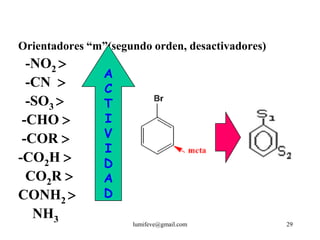
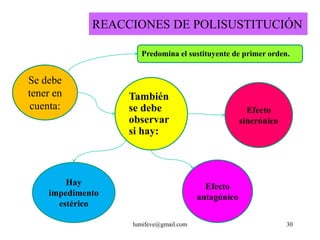
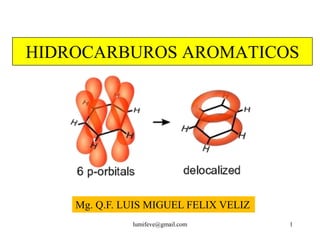
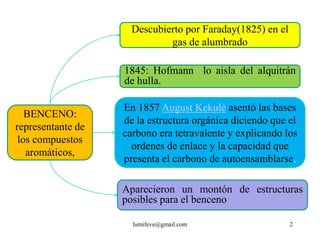
El documento resume la historia y características de los hidrocarburos aromáticos, con un enfoque en el benceno. Explica que el benceno fue descubierto en 1825 y su estructura fue establecida por Kekulé en 1857. El benceno es plano con ángulos de enlace de 120° y una conjugación que le da estabilidad. Cumple la regla de Hückel para ser aromático. Presenta reacciones de sustitución electrofílica aromática.


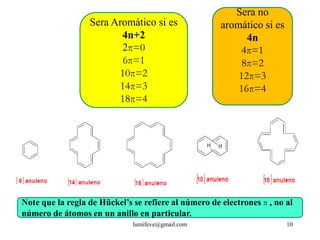
![Además debe cumplir la regla de Hückel
Para que un compuesto sea aromático el número de electrones pi en el
sistema cíclico tiene que ser 4n+2, siendo n un número entero.
Si el número de electrones pi en el sistema cíclico es 4n, siendo n
un número entero, el compuesto es antiaromático.
El benceno es un [6]anuleno con un anillo continuo de
orbitales p que se solapan. En el benceno hay seis
electrones pide modo que es un sistema 4n+2, con n=1. La
regla de Hückelpredice que el benceno seráaromático.
El ciclobutadieno es un [4]anuleno con un
anillo continuo de orbitales p que se solapan
pero tiene cuatro electrones pi. Como es un
sistema 4n, con n=1, la regla de Hückel predice
que el ciclobutadieno será antiaromático.
lumifeve@gmail.com 9](https://image.slidesharecdn.com/hidrocarburosaromaticos1-120621002653-phpapp01/85/Hidrocarburos-aromaticos-1-9-320.jpg)
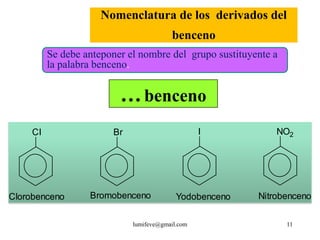
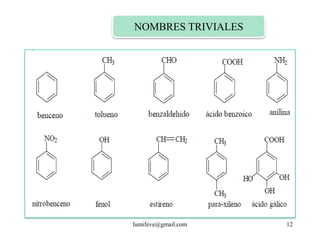
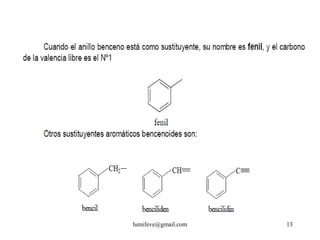
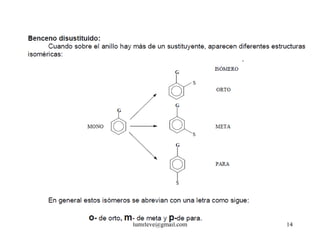

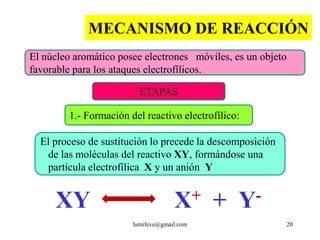
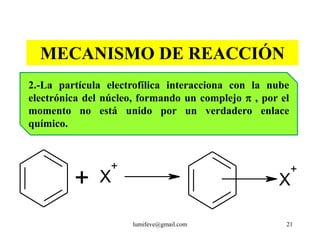
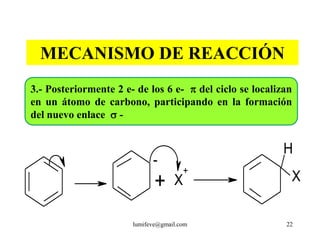
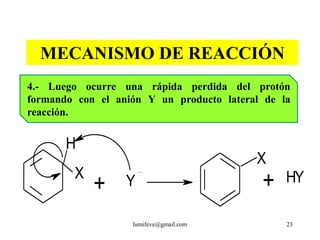
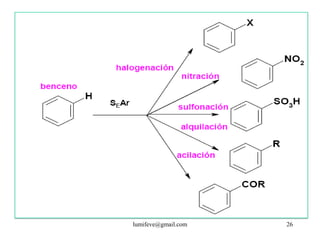
![REACCIONES DE MONOSUSTITUCIÓN
A) HALOGENACIÓN: Presencia de catalizadores:
AlCl3, AlBr3, FeCl3, FeBr3
Cl : Cl + AlCl3 Cl+ + [AlCl4]
B) NITRACIÓN: catión nitronio NO2+
H2SO4 + HNO3 NO2++2HSO4- +H3O+
C) SULFONACIÓN: grupo sulfónico (-SO3H) se
obtiene a partir de H2SO4 concentrado u oleum (fumante)
H2SO4 SO3+ + HSO4- + H3O+
lumifeve@gmail.com 24](https://image.slidesharecdn.com/hidrocarburosaromaticos1-120621002653-phpapp01/85/Hidrocarburos-aromaticos-1-24-320.jpg)
![REACCIONES DE MONOSUSTITUCIÓN
D) ALQUILACIÓN: (R- FRIEDEL-CRAFTS) introducción
del grupo R+. Se parte de un haluro de alquilo (R-X) en
presencia de un catalizador.
CH3CH2Cl + AlCl3 CH3CH2+ + [AlCl4]
E) ACILACIÓN: (R. FRIEDEL-CRAFTS) introducción
de un grupo acilo. Se parte de un haluro de acilo en
presencia de un catalizador.
CH3COCl + AlCl3 CH3CO+ + [AlCl4]
lumifeve@gmail.com 25](https://image.slidesharecdn.com/hidrocarburosaromaticos1-120621002653-phpapp01/85/Hidrocarburos-aromaticos-1-25-320.jpg)