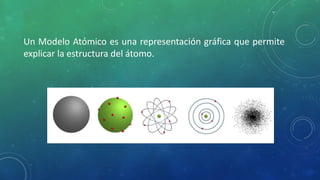
El documento resume la evolución de la teoría atómica desde modelos filosóficos en el 450 a.C. hasta modelos modernos en el siglo XX. Comenzó con Demócrito proponiendo la idea de átomos indivisibles y continuó desarrollándose con científicos como Dalton, Thomson, Rutherford, Bohr y Schrödinger que definieron el núcleo atómico, los electrones orbitando alrededor del núcleo, y los niveles de energía atómica.