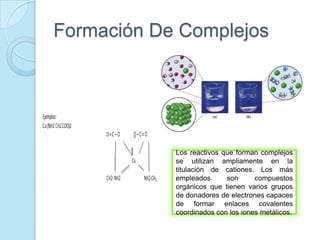
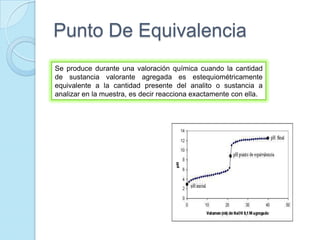
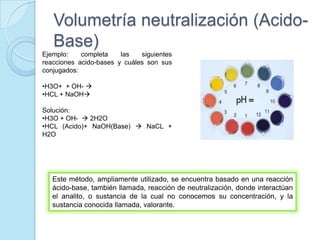
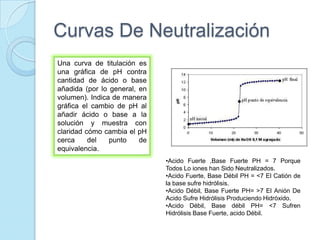
El documento presenta información sobre diferentes tipos de titulación química como titulación ácido-base, redox, por precipitación, formación de complejos y sin indicadores. También describe conceptos clave de la volumetría como punto de equivalencia, normalización, estandarización, curvas de neutralización y cálculos de reacciones químicas. Finalmente incluye una bibliografía de referencias sobre estos temas.