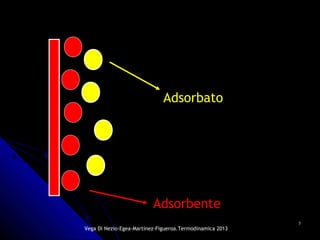
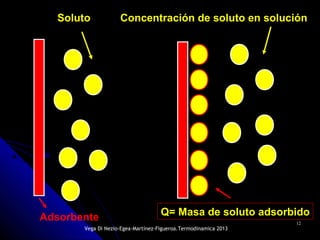
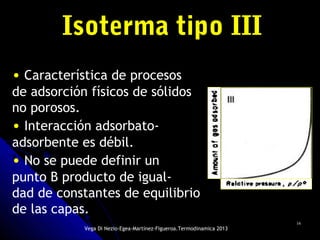
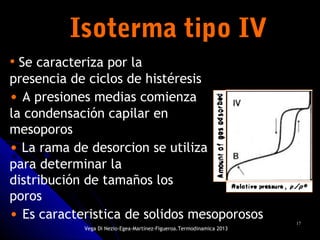
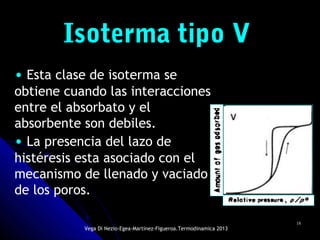
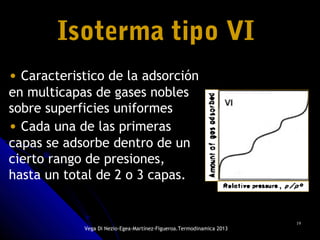
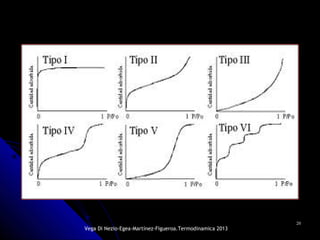
El documento se centra en los fenómenos de adsorción y absorción, explicando la diferencia entre ambos procesos y sus características. Se detallan los tipos de adsorción, como la química y la física, así como las isotermas utilizadas para describir la relación entre la cantidad de gas adsorbido y la presión. Además, se mencionan aplicaciones prácticas de la adsorción física en diversas industrias.