Resumen Unidad 1
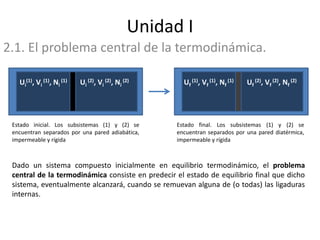
- 1. Unidad I 2.1. El problema central de la termodinámica. Uf (1), Vf(1), Nf(1) Uf (2), Vf(2), Nf(2) Estado inicial. Los subsistemas (1) y (2) se encuentran separados por una pared adiabática, impermeable y rígida Estado final. Los subsistemas (1) y (2) se encuentran separados por una pared diatérmica, impermeable y rígida Dado un sistema compuesto inicialmente en equilibrio termodinámico, el problema central de la termodinámica consiste en predecir el estado de equilibrio final que dicho sistema, eventualmente alcanzará, cuando se remuevan alguna de (o todas) las ligaduras internas. Ui(1), Vi (1), Ni (1) Ui(2), Vi (2), Ni (2)
- 2. Unidad I 2.2. Procesos unitarios y fisicoquímica. En la obtención de cualquier producto químico el proceso de transformación de la materia se pueden descomponer en una secuencia de etapas unitarias, que tienen una base científica común. Postproceso Destilación Extracción Evaporación Preparación Calentamiento Compresión Separación, etc. Reactor Transformaciones químicas Las operaciones unitariasson operaciones de naturaleza física, tales como transmisión de calor, flujo de fluidos, destilación, etc. Los cambios químicos que ocurren en el reactor, tales como nitración, polimerización, reducción, esterificacióm, etc. Se conocen como procesos unitarios. La fisicoquímica establece las bases científicas para comprender las operaciones unitarias, en cuanto a transformaciones físicas y/o químicas acompañadas de transferencia de energía.
- 3. Unidad I 2.3. Definiciones de fase, componente, etc. Un sistema se considera homogéneo si todas las propiedades intensivas son funciones continuas de la posición a través de todo el sistema. Si el sistema es homogéneo se dice que se encuentra en una sola fase. Las fases pueden ser líquidas, sólidas o gaseosas. En un sistema heterogéneo las propiedades intensivas muestran discontinuidades. Dichas discontinuidades, se localizan en superficies que encierran regiones homogéneas (fases) del sistema. Las superficies son conocidas como interfases. Se define un componente de un sistema como una sustancia de naturaleza química determinada cuya cantidad en el sistema se puede variar de manera independiente. El número de componentes de un sistema es el número mínimo de compuestos químicos independientes, con los que se constituye el sistema.
- 4. Unidad I 2.3. Definiciones de fase, componente, etc. Ejercicio: Cuando se disuelve en agua un ácido débil HA, se establecen los siguientes equilibrios iónicos: HA = H+ + A- H2O = H+ + OH- En la disolución están presentes las especies químicas: HA, H2O, H+, OH- y A- ¿Cuántas de ellas son independientes? nH+=nOH- + nA- En este curso estamos interesados en sistemas multifásicos y multicomponentes. Comenzaremos el estudio por establecer la ecuación fundamental para un sistema de una sola fase, con varios componentes.
- 5. Unidad I 2.4. Ecuación fundamental de sistemas multicomponentes. Para un sistema con un componente puro, la primera ley establece que existe una relación U=U(S, V), que en la forma diferencial se expresa como: dU= TdS – PdV Para un sistema multicomponente, la ecuación característica es de la forma U=U(S, V, n1,…nC), siendo C el número de componentes. La ecuación diferencial es entonces dU= TdS– PdV + 𝑖𝐶𝜕𝑈𝜕𝑛𝑖𝑆,𝑉,𝑛𝑗𝑑𝑛𝑖 El estado del sistema multicomponente se puede modificar por: Tranferencia de calor, sin cambio en el volumen y sin variación en la composición Cambio del volumen, con paredes impermeables y adiabáticas Cambio en la composición. Potencial químico
- 6. Unidad I 2.4. Ecuación fundamental de sistemas multicomponentes. dT produce tranferencia de energía en forma de calor dP produce trabajo mecánico dn produce trabajo químico, n puede variar por reacción química o por migración de especies dWquim= 𝑖𝐶𝜕𝑈𝜕𝑛𝑖𝑆,𝑉,𝑛𝑗𝑑𝑛𝑖=𝑖𝐶𝜇𝑖𝑑𝑛𝑖 Para los otros potenciales termodinámicos, podemos escribir de forma inmediata las expresiones que incluyen el potencial químico dH= TdS+ VdP+ 𝑖𝐶𝜕𝑈𝜕𝑛𝑖𝑆,𝑉,𝑛𝑗𝑑𝑛𝑖 dA= -SdT– PdV+ 𝑖𝐶𝜕𝑈𝜕𝑛𝑖𝑆,𝑉,𝑛𝑗𝑑𝑛𝑖 dG= -SdT+VdP+ 𝑖𝐶𝜕𝑈𝜕𝑛𝑖𝑆,𝑉,𝑛𝑗𝑑𝑛𝑖
