Este documento describe los diferentes tipos de enlaces químicos, incluyendo enlaces covalentes, iónicos y de hidrógeno. Explica cómo se forman estos enlaces y cómo afectan las propiedades de los compuestos. También describe la geometría molecular de las moléculas, prediciendo su forma basada en el número de electrones alrededor del átomo central y la repulsión entre pares de electrones. Proporciona ejemplos detallados de cómo aplicar estos conceptos para predecir las estructuras de moléculas





















































































































![121
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL
FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS
TAREA # 10
CINÉTICA QUÍMICA
Estudiante: _____________________________________.
Fecha: _______________________.
Profesor: Ing. Quím. Diego Muñoz Naranjo, M. Sc.
Paralelo: _____________________.
DEBER DE QUÍMICA
1) Considere la siguiente reacción entre el cloruro de mercurio (II) y el ión oxalato
2HgCl2 (ac)
+
C2O4= (ac)
---------)
2Cl- (ac)
+
2CO2(g)
+
Hg2Cl2(s)
Se determinó la velocidad inicial de esta reacción para varias concentraciones de HgCl2 y de C2O4= , y los siguientes datos de velocidad se obtuvieron para la velocidad de desaparición del C2O4=:
Experimento
[HgCl2] M
[C2O4=] M
Velocidad (M/s)
1
0.164
0.15
3.2 * 10 -5
2
0.164
0.45
2.9 * 10 -4
3
0.082
0.45
1.4 * 10 -4
4
0.246
0.15
4.8* 10 -4
Determinar:
a) ¿Cuál es la velocidad para esta reacción?
b) ¿Cuál es el valor de la constante de velocidad?
c) ¿Cuál es la velocidad de la reacción cuando la concentración de HgCl2 es de 0.100 M y la del C2O4= es de 0.25 M, si la Temperatura es la misma utilizada para los datos anteriores?
2) El ciclopentadieno (C5H6) reacciona consigo mismo para formar ciclopentadieno (C10H12). Se vigila una disolución de C5H6 0.0400 M con una función del tiempo a medida que ocurría el avance de la reacción 2 C5H6 -----) C10H12. Se obtuvieron los datos siguientes:
Tiempo (s)
0
50
100
150
200
[C5H6] M
0.0400
0.0300
0.0240
0.0200
0.0174
Determinar:](https://image.slidesharecdn.com/gua-141107000906-conversion-gate01/85/Guia-121-320.jpg)
![122
a) Por medio grafico cuál es el orden de la reacción.
b) ¿Cuál es el valor de la constante de velocidad?
3) La constante de velocidad de primer orden para la reacción de un compuesto orgánico particular con agua varía con la Temperatura de la siguiente manera:
Temperatura (K)
0
50
100
150
200
Velocidad cte. [s-1]
0.0400
0.0300
0.0240
0.0200
0.0174
A partir de estos datos, por medio de un grafico, calcule la energía de activación en unidades de Kj/mol.
4) Se estudia la descomposición en fase gaseosa del NO2, 2NO2 (g) -----) 2NO(g) + O2 (g), a 383 °C, dando los siguientes datos:
Tiempo (s)
0
10
20
30
40
[NO2] (M)
0.20
0.034
0.018
0.0124
0.0094
DETERMINAR
a) Es la reacción de primer o segundo orden respecto a la concentración de NO2
b) ¿Cuál es el valor de la constante de velocidad?
5) A partir de los siguientes datos de la reacción del cloruro de butilo en agua, Calcular.
a) Δt , ΔM, Velocidad promedio, para cada intervalo.
b) la velocidad instantánea cuando t= 600 seg.
Tiempo (s)
Δt
[C4H9Cl] (M)
ΔM
Velocidad promedio (M/s)
0
0.100
50
0.0905
100
0.0820
150
0.0741](https://image.slidesharecdn.com/gua-141107000906-conversion-gate01/85/Guia-122-320.jpg)










![133
Estudiante: ______________________________________.
Paralelo: ______________.
Profesor: Ing. Quím. Diego Muñoz, M.Sc.
Fecha: ________________.
TALLER DE QUÍMICA
1) El alcanfor (C10H16O) funde a 179,8ºC y tiene una constante de abatimiento del punto de congelación excepcionalmente grande, Kf = 40ºC/m. Si 0,186 g de una sustancia orgánica desconocida se disuelve en 22,01 g de alcanfor líquido, se observa que el punto de congelación de la mezcla es de 176,7ºC. Calcule la masa molar del soluto. Datos: C=12g; H=1g; O=16g.
2) En una mezcla de pentano y hexano, la fracción mol del pentano es 0,5443. La presión de vapor del pentano es 420,8 mmHg y la del hexano es 101,9 mmHg a 20,0 ºC. Con los datos presentados, calcular -en los espacios de la tabla- la presión de vapor de la mezcla sobre la solución a 20,0 ºC. Luego, considerando que la solución referida es ideal a la temperatura indicada, dibujar a mano alzada, la variación de la presión de vapor sobre la solución en dependencia de la fracción mol del pentano o hexano.
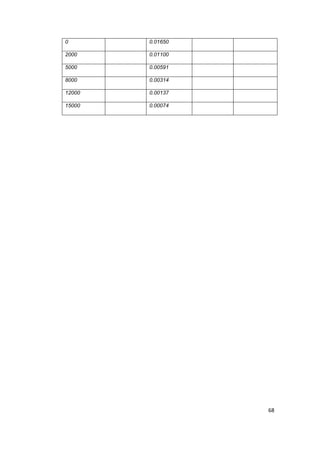
3) Se estudió experimentalmente la isomerización del metil isonitrilo (CH3NC) a acetonitrilo (CH2CN) en fase gaseosa a 215º C y se obtuvieron los datos indicados en las dos primeras filas de la tabla. Con la información proporcionada en primer lugar calcule la velocidad media de reacción, M/s, en el intervalo de tiempo entre cada medición: Luego, grafique [CH3NC] en función del tiempo y proceda a determinar gráficamente la velocidad instantánea (M/s) a t = 5000 y t = 8000:
Tiempo (s)
0
2,000
5,000
8,000
12,000
15,000
[CH3NC] M
0.0165
0.0110
0.00591
0.00314
0.00137
0.00074
Velocidad Media (M/s)
2.75 x 10-6
1.70 x 10-6
9.23 x 10-7
4.43 x 10-7
2.1 x 10-7
4) ¿Cuántos gramos de bicromato de potasio (K2Cr2O7) se requieren para preparar 250 mL de una disolución cuya concentración sea 2.16 M?
ESCUELA SUPERIOR POLITÉCNICA DEL LITORAL
FACULTAD DE CIENCIAS NATURALES Y MATEMÁTICAS
DEPARTAMENTO DE CIENCIAS QUIMICAS Y AMBIENTALES
TALLER GENERAL 3](https://image.slidesharecdn.com/gua-141107000906-conversion-gate01/85/Guia-133-320.jpg)
![134
Peso atómico de: K=39.098, Cr=51.996. O=15.999
5) La reacción del óxido nítrico con hidrógeno a 1280 oC es:
2NO (g) + 2H2 (g) → N2 (g) + 2H2O (g)
A partir de los siguientes datos medidos a dicha temperatura, determine lo solicitados en los literales a, b y c:
EXPERIMENTO
[NO] (M)
[H2] (M)
VELOCIDAD INICIAL (M/s)
1
5 X 10-3
2 X 10-3
1.3 X 10-5
2
10 X 10-3
2 X 10-3
5 X 10-5
3
10 X 10-3
4 X 10-3
10 X 10-5
Determinar:
a) Orden de la reacción
b) Constante de velocidad.
c) La velocidad de la reacción cuando [NO] = 12 x 10-3 M y [H2] = 6 x 10-3M.
6) La temperatura de ebullición de una solución acuosa de etilenglicol es 101,25 ºC. Determinar la temperatura de congelación de la solución.
Kb = 0.52 Kc = 1.86
7) La solubilidad del nitrógeno gaseoso en agua a 25 °C y 1 atm es de 6.8 * 10 -4 mol/L. ¿Cuál es la concentración (en molaridad) del nitrógeno disuelto en agua bajo condiciones atmosféricas? La presión parcial del nitrógeno gaseoso en la atmósfera es de 0.78 atm.
¿Por qué tuvo lugar la disminución en la solubilidad del nitrógeno gaseoso?
8) El Etilenglicol (EG), CH2(OH)CH2(OH), es un anticongelante utilizado en automóviles. Es soluble en agua y bastante no volátil (p. de ebullición 197°C). calcule el punto de congelación de una disolución que contenga 651 g de esta sustancia en 2.505 g de agua. ¿Debe mantener esta sustancia en el radiador de su automóvil durante nuestro invierno (verano europeo)? La masa molar del etilenglicol es de 62.07 g.?
Constantes molares de elevación del punto de ebullición y de disminución del punto de congelación de varios líquidos comunes (medido a 1 atm)
Disolvente
Punto de congelación normal (°C)
Kf
(°C/m)
Punto de ebullición mnormal (°C)
Kb
(°C/m)
Agua
0
1.86
100
0.52
9) Se prepara una disolución disolviendo 50 gramos de hemoglobina 8hb) en suficiente agua para obtener un volumen de 3000 mililitros. Si la presión osmótica de la disolución es de 30.00 mm Hg a 25°C, calcule la masa molar de la hemoglobina. ¿Qué unidades debemos utilizar para la presión osmótica y para la temperatura?
10) La constante de rapidez de primer orden para la reacción de cloruro de metilo (CH3Cl) con agua para producir metanol (CH3OH) y ácido clorhídrico (HCl) es 3.32 *10-10 s-1 a 25°C. sírvase calcular la constante de rapidez a 40°C si la Energía de activación es de 116 Kj/mol.](https://image.slidesharecdn.com/gua-141107000906-conversion-gate01/85/Guia-134-320.jpg)
![135
11) Calcule en primer lugar, la presión de vapor de una disolución preparada al disolver 218 gramos de glucosa (masa molar 180.2 g/mol) en 460 ml de agua a 30°C. luego determine la disminución en la presión de vapor a esta temperatura en relación a la presión del agua (solvente puro), esto luego de la intervención de la glucosa sobre el agua.
12) Calcule la concentración de OH- y el pH en una disolución 0.15 M de NH3.
13) Complete la tabla:
pH
pOH
[H+] M
[OH-] M
¿ácida ó básica?
6.21
10.13
3.5 *10-3
5.6 *10-4](https://image.slidesharecdn.com/gua-141107000906-conversion-gate01/85/Guia-135-320.jpg)
