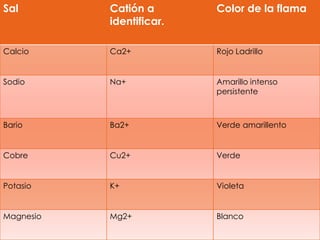
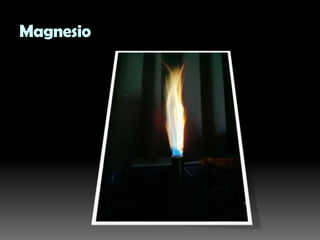
Este documento describe un experimento para identificar cationes mediante análisis de llama. Se utilizaron sales de sodio, potasio, calcio, hierro, cobre, estroncio y magnesio, las cuales produjeron colores característicos en la llama indicando la presencia de cada catión. El método permitió identificar con éxito los cationes presentes y podría usarse para analizar la composición inorgánica de suelos.