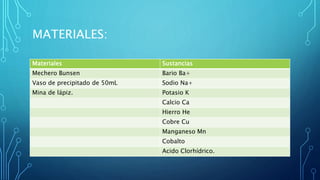
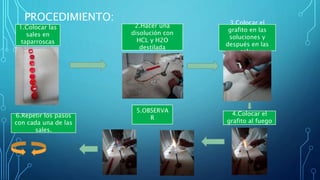
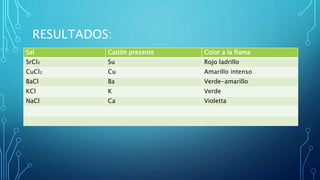
Este documento describe un experimento de laboratorio para identificar cationes mediante el análisis a la flama. Se colocan muestras de sales con diferentes cationes en grafito y se calientan, produciendo varios colores característicos que permiten identificar cada catión. El experimento concluye que es posible reconocer cationes como bario, sodio y potasio mediante la coloración que producen al ser calentados.