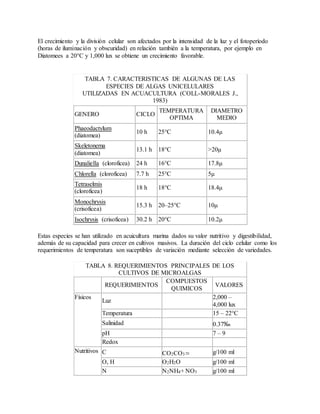
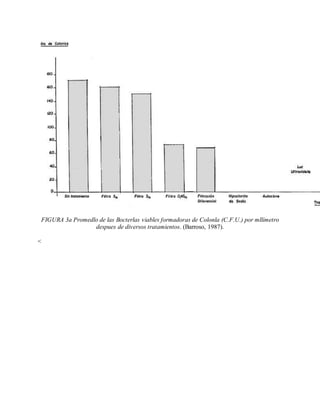
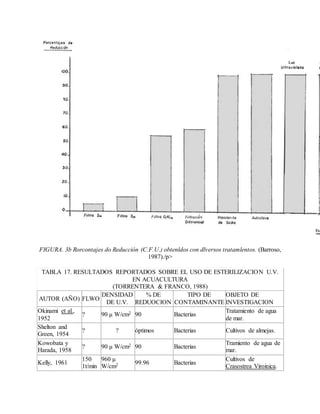
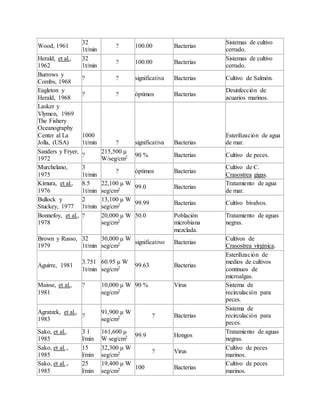
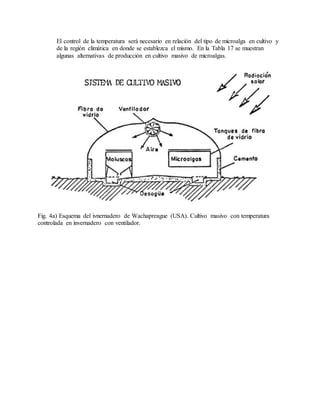
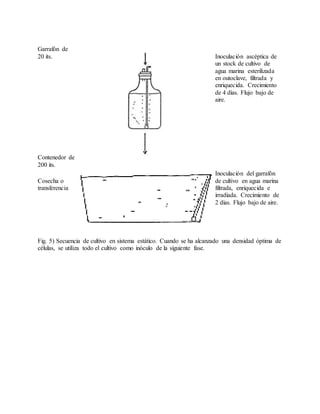
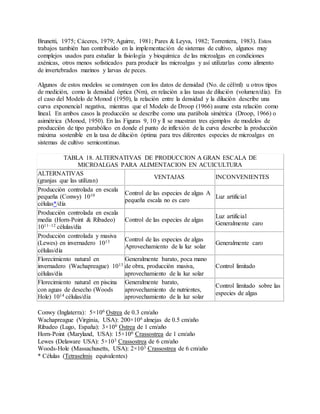
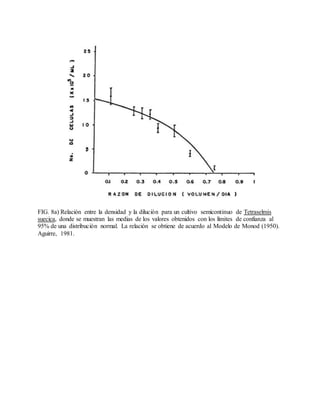
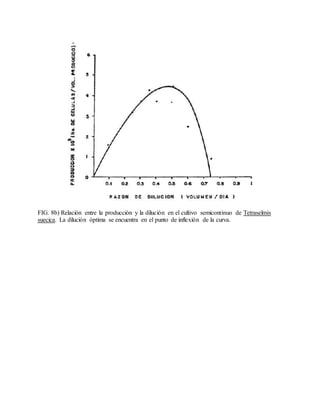
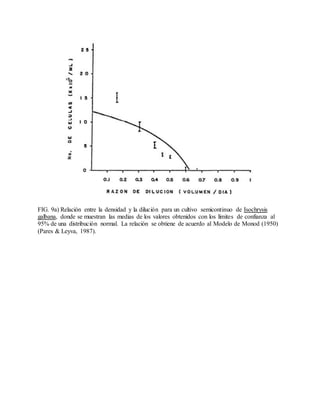
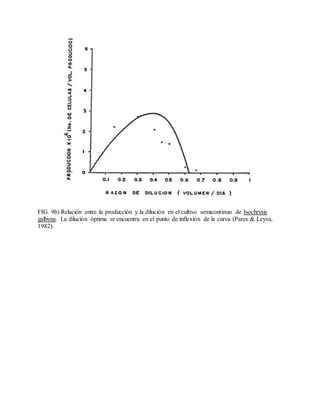
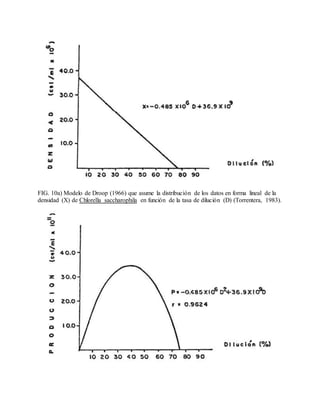
Este documento describe varios aspectos relacionados con el cultivo de microalgas, incluyendo diferentes especies de microalgas utilizadas en acuacultura, factores que afectan su crecimiento como la luz, temperatura y composición química del medio, y diferentes medios de cultivo comúnmente empleados. También presenta tablas con las características y requerimientos de cultivo de diversas especies de microalgas de interés acuícola.