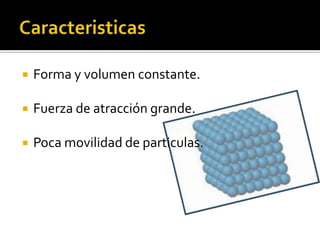
Este documento presenta información sobre la química a través de la historia y su importancia en diferentes áreas como la salud, energía, materiales y alimentos. Explica que la química comenzó en la Edad de Piedra y se define actualmente como el estudio de la materia y sus cambios. También describe tres logros importantes en salud del siglo XX como la cirugía con anestesia, terapia génica y la decodificación del genoma humano. Finalmente, explica que la química busca fuentes alternativas de energ