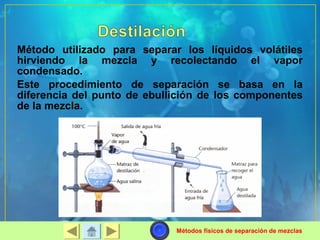
Este documento presenta conceptos básicos de química, incluyendo los estados de la materia, clasificación de sustancias, propiedades físicas y químicas, y métodos para separar mezclas. Explica que la materia puede existir en sólido, líquido, gas o plasma, y describe las propiedades características de cada estado. Además, distingue entre sustancias puras, elementos y compuestos, y entre mezclas homogéneas y heterogéneas. Finalmente, resume diferentes técnicas para separ