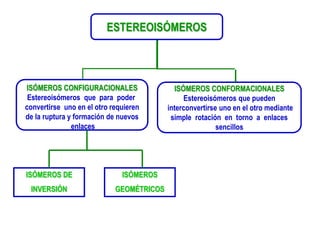
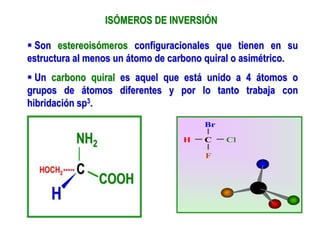
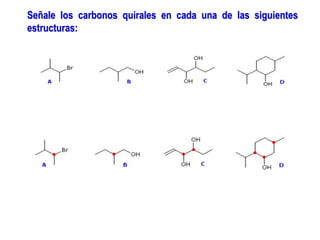
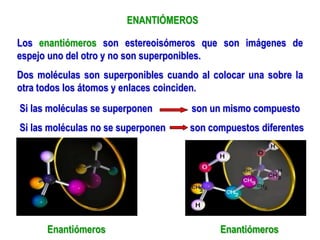
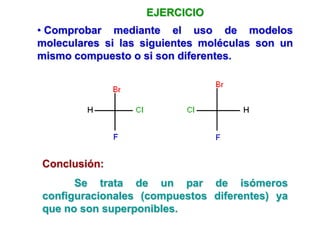
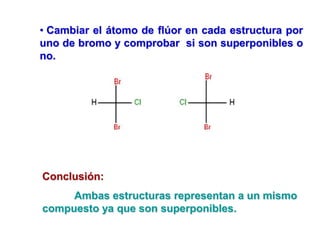
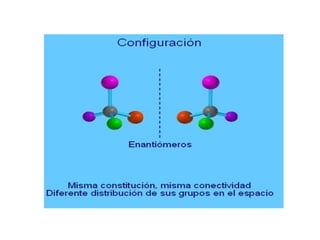
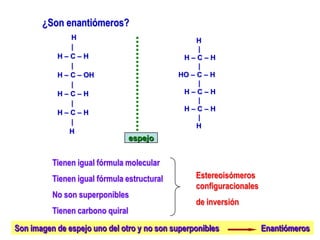
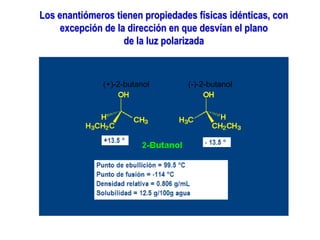
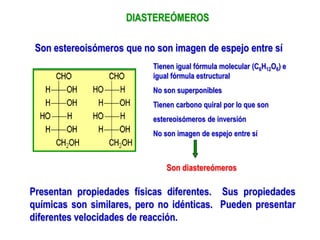
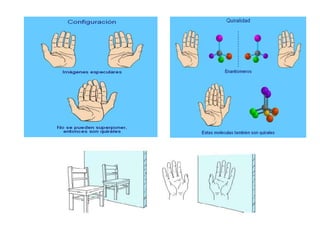
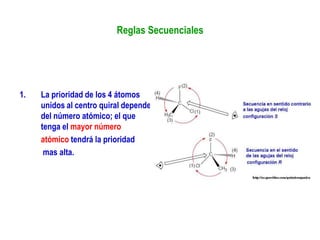
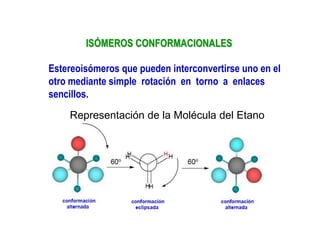
El documento describe diferentes tipos de isómeros, incluyendo isómeros estructurales, estereoisómeros, isómeros configuracionales, isómeros conformacionales, enantiómeros, y diastereómeros. Los estereoisómeros son compuestos que tienen la misma fórmula molecular y estructural pero difieren en la orientación espacial de sus átomos. Los enantiómeros son estereoisómeros que son imágenes especulares no superponibles, mientras que los diastereómeros no son imágenes