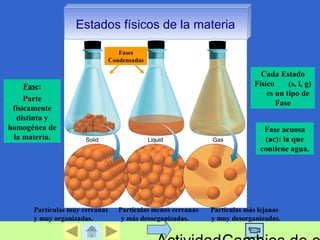
Este documento trata sobre la química y los estados de la materia. Explica que la materia puede existir en diferentes estados físicos como sólido, líquido y gas, y describe las propiedades características de cada estado. También define conceptos como sustancias puras, mezclas, y cambios de estado, y describe métodos para separar mezclas como filtración, destilación y evaporación.