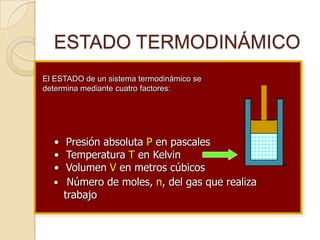
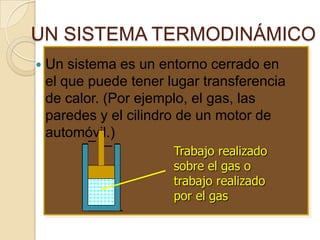
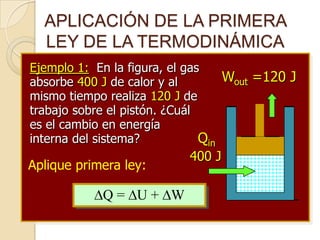
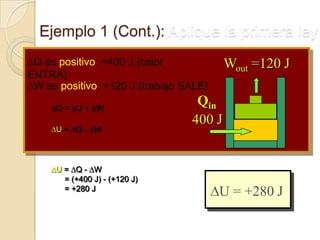
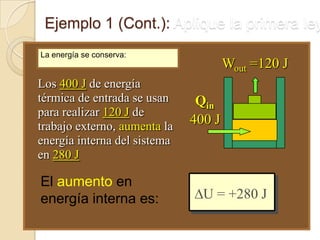
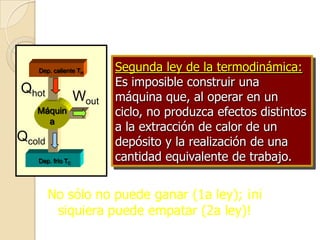
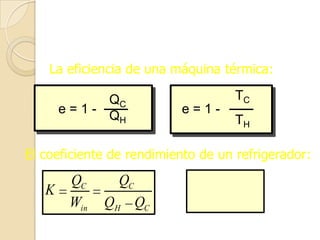
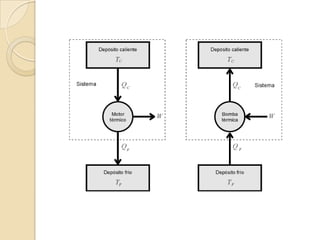
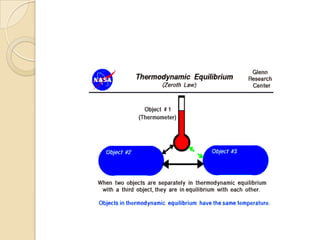
El documento introduce los conceptos fundamentales de la termodinámica, incluyendo que estudia las relaciones de energía involucrando calor, trabajo y transferencia de calor. Explica que el estado de un sistema termodinámico se define por su presión, temperatura, volumen y número de moles. También describe las leyes de la termodinámica, incluyendo que la energía se conserva y que es imposible crear una máquina con 100% de eficiencia.